Unterschied zwischen Essigsäure und Propionsäure
Der Schlüsselunterschied zwischen Essigsäure und Propionsäure ist das Essigsäure ist eine Carboxsäure, die zwei Kohlenstoffatome enthält, während Propionsäure eine Carboxsäure ist, die drei Kohlenstoffatome enthält.
Essigsäure und Propionsäure sind einfache Carboxsäuren mit zwei bzw. drei Kohlenstoffatomen pro Molekül. Sie haben unterschiedliche chemische und physikalische Eigenschaften.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Essigsäure
3. Was ist Propionsäure
4. Seite an Seitenvergleich - Essigsäure gegen Propionsäure in tabellarischer Form
5. Zusammenfassung
Was ist Essigsäure?
Essigsäure ist die zweit einfachste Carbonsäure mit der chemischen Formel CH3Cooh. Es ist eine farblose Flüssigkeit mit einem scharfen, Essig-ähnlichen Geruch. Es hat auch einen unverwechselbaren sauren Geschmack. Diese Verbindung hat eine Methylgruppe, die an eine Carbonsäure gebunden ist. Es ist eine schwache Säure, weil sie teilweise in einer wässrigen Lösung dissoziiert. Die Molmasse von Essigsäure beträgt 60.05 g/mol. Die konjugierte Base dieser Säure ist Acetation. Darüber hinaus ist der systemische IUPAC -Name von Essigsäure Ethansäure.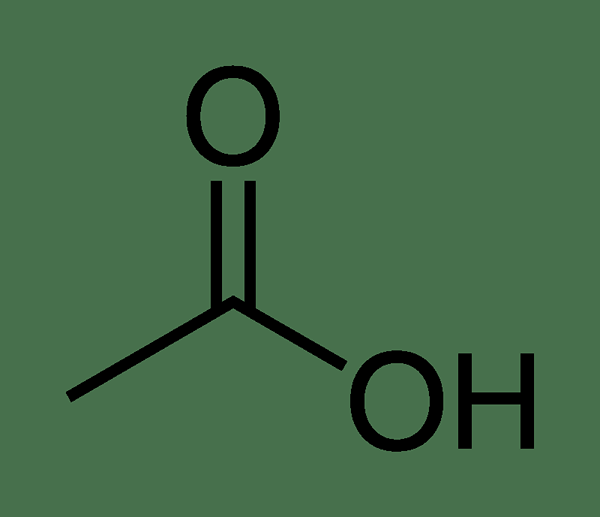
In seiner festen Form bilden Essigsäureketten, indem die Moleküle durch Wasserstoffbrückenbindungen verbunden sind. In seiner Dampfphase gibt es Dimere von Essigsäure. Darüber hinaus ist es in seinem flüssigen Zustand ein hydrophiles protisches Lösungsmittel. Darüber hinaus existiert diese Verbindung bei physiologischen pH -Bedingungen in einer vollständig ionisierten Form als Acetat. Wir können Essigsäure sowohl auf synthetischen als auch auf bakteriellen Fermentationsrouten produzieren. Darüber hinaus wird auf dem synthetischen Weg Essigsäure über Methanol -Carbonylierung erzeugt.
Was ist Propionsäure?
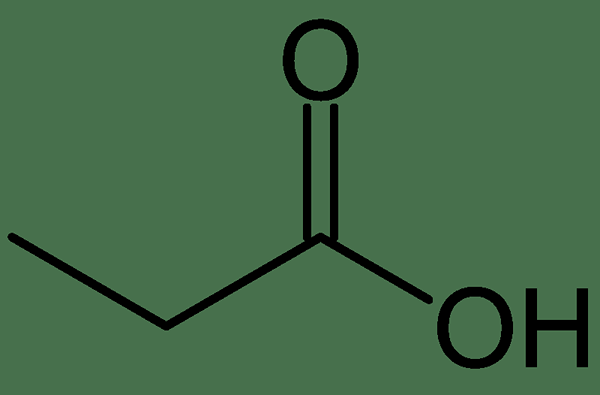
Propionsäure ist die dritte einfache Carbonsäure mit der chemischen Formel CH3CH2CO2H. Es hat drei Kohlenstoffatome pro Propionsäuremolekül. Auch seine Molmasse beträgt 74.079 g/mol. Es tritt bei Standardtemperatur als farblose, ölige Flüssigkeit auf. Es hat auch einen scharfen, ranzigen Geruch. Darüber hinaus ist diese Verbindung mit Wasser mischbar und wir können sie aus Wasser entfernen, indem wir ein Salz hinzufügen.

Sowohl in flüssigen als auch in den Dampfphasen tritt Propionsäure als Dimere auf. Darüber hinaus können wir diese Säure in Industriellen über die Hydrokboxylierung von Ethylen in Gegenwart eines Katalysators produzieren. In den meisten Fällen sind der Katalysator, den wir verwenden, Nickelcarbonylverbindungen.
Was ist der Unterschied zwischen Essigsäure und Propionsäure?
Essigsäure ist die zweit einfachste Carbonsäure mit der chemischen Formel CH3Cooh, während Propionsäure die dritte einfache Carbonsäure ist, die die chemische Formel CH hat3CH2CO2H. Der Schlüsselunterschied zwischen Essigsäure und Propionsäure besteht darin.
Darüber hinaus ist ein weiterer Unterschied zwischen Essigsäure und Propionsäure ihr Geruch; Essigsäure hat einen scharfen, essigähnlichen Geruch, während Propionsäure einen scharfen, ranzigen Geruch hat. In fester Form formen Ketten mit Essigsäure durch Zusammenhänge der Moleküle durch Wasserstoffbrückenbindungen, während es in der Dampfphase Dimere bildet und in seinem flüssigen Zustand ein hydrophiles protisches Lösungsmittel ist. Sowohl in flüssigen als auch in Dampfphasen gibt es jedoch Dimere von Propionsäure.
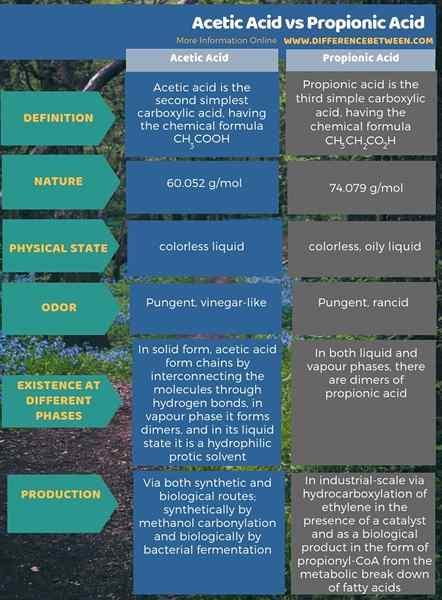
Zusammenfassung -Essigsäure gegen Propionsäure
Essigsäure ist die zweit einfachste Carbonsäure mit der chemischen Formel CH3Cooh, während Propionsäure die dritte einfache Carbonsäure mit der chemischen Formel CH ist3CH2CO2H. Der Schlüsselunterschied zwischen Essigsäure und Propionsäure besteht darin.
Referenz:
1. Plessi, m. "Essig.” Enzyklopädie von Lebensmittelwissenschaften und Ernährung, 2003, pp. 5996-6004., doi: 10.1016/B0-12-227055-X/01251-7.
Bild mit freundlicher Genehmigung:
1. "Essigsäure-2D-Skelettal" (Public Domain) über Commons Wikimedia
2. „Propionsäure -chemische Struktur“ durch х х р серchesй - eigene Arbeit (Public Domain) über Commons Wikimedia


