Unterschied zwischen Acetylen und Ethylen

Schlüsselunterschied - Acetylen vs Ethylen
Der Schlüsselunterschied Zwischen Acetylen und Ethylen ist das Acetylen hat eine dreifache Bindung zwischen zwei Kohlenstoffatomen, während Ethylen eine doppelte Bindung zwischen zwei Kohlenstoffatomen aufweist.
Die Namen Acetylen und Ethylen klingen ähnlich, aber sie sind unterschiedliche Kohlenwasserstoffverbindungen. Sie haben jedoch auch einige Ähnlichkeiten. Dieser Artikel beschreibt sowohl die Ähnlichkeiten als auch die Unterschiede zwischen Acetylen und Ethylen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Acetylen
3. Was ist Ethylen
4. Ähnlichkeiten zwischen Acetylen und Ethylen
5. Seite an Seitenvergleich - Acetylen gegen Ethylen in tabellarischer Form
6. Zusammenfassung
Was ist Acetylen?
Acetylen ist eine organische Verbindung mit der chemischen Formel C2H2. Darüber hinaus ist es das einfachste Alkin unter Kohlenwasserstoffen. Ein Alkin ist eine Verbindung mit einer dreifachen Bindung zwischen zwei Kohlenstoffatomen. Daher hat Acetylen eine dreifache Bindung zwischen den beiden Kohlenstoffatomen, die es hat. Es gibt zwei PI -Bindungen und eine Sigma -Bindung zwischen diesen Kohlenstoffatomen. Das Molekül hat eine lineare Geometrie, da ein Kohlenstoffatom nur vier kovalente Bindungen bilden kann (Acetylen hat eine dreifache Bindung und eine einzelne Bindung C-H, wodurch das Molekül linear wird). Daher werden die Kohlenstoffatome des Acetylenmoleküls SP hybridisiert.
Chemische Eigenschaften von Acetylen
Einige chemische Fakten über Acetylen sind wie folgt:
- Chemische Formel = C2H2
- Molmasse = 26.04 g/mol
- Physischer Zustand bei Raumtemperatur = es ist ein farbloses Gas
- Geruch = geruchlos
- Schmelzpunkt = -80.8 ° C
- Siedepunkt = -84 ° C
- Löslichkeit im Wasser = leicht löslich
- IUPAC Name = Ethyne
Darüber hinaus existiert Acetylen nicht als Flüssigkeit im atmosphärischen Druck. Daher hat es keinen tatsächlichen Schmelzpunkt. Die oben angegebene Schmelztemperatur ist eigentlich der dreifache Acetylenpunkt. Daher wird die feste Form von Acetylen eher Sublimation als schmelzend. Dort wird feste Acetylen in Dampf umgewandelt.

Abbildung 01: Verwendung von Oxy-Acetylen-Flamme
Die Hauptanwendung von Acetylen liegt in Schweißprozessen. Die Oxy-Acetylen-Flamme ist eine Hochtemperaturflamme, die beim Schweißen und Schneiden wichtig ist. Wir können diese Flamme aus der Verbrennung von Acetylen mit Sauerstoff produzieren.
Was ist Ethylen?
Ethylen ist eine organische Verbindung mit der chemischen Formel C2H4. Es gibt zwei Kohlenstoffatome, die über eine Doppelbindung aneinander verbunden sind (eine PI -Bindung und Sigma -Bindung). Daher hat das Ethylenmolekül zwei sp2 hybridisierte Kohlenstoffatome. Da ein Kohlenstoffatom in der Lage ist, vier chemische Bindungen zu bilden, gibt es zwei Wasserstoffatome, die über einzelne Bindungen an jedes Kohlenstoffatom gebunden sind. Dann hat das Ethylenmolekül eine planare Struktur.
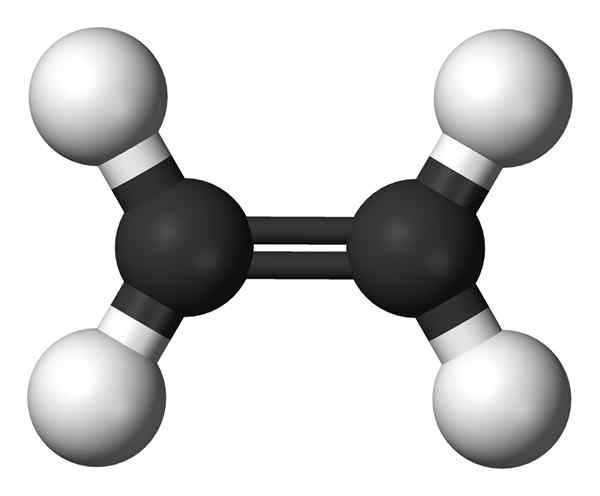
Abbildung 02: Die chemische Struktur von Ethylen
Einige chemische Fakten über Ethylen sind wie folgt:
- Chemische Formel = C2H4
- Molmasse = 28.05 g/mol
- Physischer Zustand bei Raumtemperatur = Es ist ein farbloses, brennbares Gas
- Geruch = süßer Geruch
- Schmelzpunkt = –169.2 ° C
- Siedepunkt = –103.7 ° C
- Löslichkeit im Wasser = leicht löslich
- IUPAC Name = Ethene
Die Hauptquelle für Ethylen ist Rohöl und Erdgase. Es gibt drei Hauptprozesse zur Herstellung von Ethylen aus diesen Quellen. Sie sind;
- Dampfrisse von Ethan und Propan
- Dampfrisse von Naphtha
- Katalytisches Riss von Gasöl
Ethylen besitzt wichtige Verwendungen als Monomere für die Herstellung von Polymeren wie Polyethylen über Additionspolymerisation. Polyethylen ist ein übliches Verpackungsmaterial. Darüber hinaus ist Ethylen in biologischen Systemen als Pflanzenhormon wichtig, da es den Fruchtreifungsprozess stimuliert.
Was sind die Ähnlichkeiten zwischen Acetylen und Ethylen?
- Beide sind kleine Kohlenwasserstoffe.
- Acetylen und Ethylen bestehen nur aus Kohlenstoffatomen und Wasserstoffatomen.
- Beide sind farblose Gase.
- Sowohl Acetylen als auch Ethylen sind brennbare Gase.
- Acetylen und Ethylen sind planare Strukturen.
Was ist der Unterschied zwischen Acetylen und Ethylen?
Acetylen gegen Ethylen | |
| Acetylen ist eine organische Verbindung mit der chemischen Formel C2H2. | Ethylen ist eine organische Verbindung mit der chemischen Formel C2H4. |
| Anzahl der Wasserstoffatome | |
| Acetylen hat zwei Wasserstoffatome in einem Acetylenmolekül. | Ethylen hat vier Wasserstoffatome in einem Ethylenmolekül. |
| Molmasse | |
| Die Molmasse von Acetylen beträgt 26.04 g/mol. | Die Molmasse von Ethylen beträgt 28.05 g/mol. |
| Chemische Bindung | |
| Acetylen hat eine dreifache Bindung zwischen zwei Kohlenstoffatomen und zwei C-H-Einzelbindungen. | Ethylen hat eine doppelte Bindung zwischen zwei Kohlenstoffatomen und vier C-H-Einzelbindungen. |
| Hybridisierung von Kohlenstoffatomen | |
| Die Kohlenstoffatome des Acetylenmoleküls werden SP hybridisiert. | Die Kohlenstoffatome des Ethylenmoleküls werden sp2 hybridisiert. |
Zusammenfassung - Acetylen vs Ethylen
Acetylen und Ethylen sind aufgrund ihres weiten Anwendungsbereichs sehr wichtige Kohlenwasserstoffverbindungen. Der Unterschied zwischen Acetylen und Ethylen besteht darin, dass Acetylen eine dreifache Bindung zwischen zwei Kohlenstoffatomen hat.
Referenz:
1. "Acetylen.”Wikipedia, Wikimedia Foundation, 14. April. 2018. Hier verfügbar
2. „Ethylen.”Wikipedia, Wikimedia Foundation, 18. April. 2018. Hier verfügbar
3. "Acetylen.Nationales Zentrum für Biotechnologieinformationen. Pubchem Compound -Datenbank, u.S. Nationalbibliothek für Medizin. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.'US Navy 070413-2943C-001 Hull-Techniker Troy Heffner leuchtet vor einem Schweißjob im Hull Technician Shop'By u einen Sauerstoff-Acetyl-Torch auf.S. Marinefoto von Massenkommunikationsspezialisten Carlos Cepeda (Public Domain) über Commons Wikimedia
2.'Ethylen-3D-Balls'By Benjah-BMM27-eigene Arbeit, (öffentlich zugänglich) über Commons Wikimedia


