Unterschied zwischen saurem Salz und Basissalz

Der Schlüsselunterschied zwischen saurem und basischem Salz ist das Saure Salze bilden eine Lösung, die weniger als pH 7 ist.0 Wenn in Wasser gelöst wird, bilden Basissalze eine Lösung, die höher als pH 7 ist.0 Wenn es in Wasser aufgelöst wird.
Ein Salz ist eine ionische Verbindung, die ein Kation und ein Anion enthält. Es ist eine feste Verbindung, die keine Nettoladung hat, da sich die Kationen und Anionen so miteinander verbinden, dass die elektrische Ladung der Kationen mit der von Anionen ausgeglichen ist. Abhängig von der ionischen Zusammensetzung eines Salzes können die Eigenschaften und die Reaktivität bestimmt werden. Daher können wir ein Salz in drei Gruppen als saure Salze, Basissalze und neutrale Salze kategorisieren.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist ein saures Salz?
3. Was ist ein einfaches Salz
4. Seite an Seite Vergleich - Saures Salz gegen Basissalz in tabellarischer Form
5. Zusammenfassung
Was ist ein saures Salz??
Saure Salze sind ionische Verbindungen, die bei Auflösung im Wasser saure Lösungen bilden können. Das bedeutet; Das saure Salz bildet eine wässrige Lösung, die weniger als pH 7 ist.0. Dies geschieht entweder aufgrund des Vorhandenseins eines Metallkation. Am häufigsten enthalten saure Salze hydrolysible Protonen. Diese hydrolysiblen Protonen können entweder im Kation oder im Anion existieren.
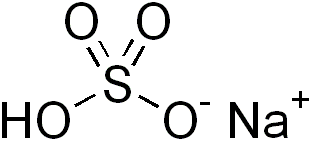
Abbildung 01: Natrium Bisulfit ist ein saures Salz
Hydrolysible Protonen im Kation
Saure Salze, die Kationen mit hydrolysiblen Protonen enthalten, sind hauptsächlich Ammoniumionen. Ammoniumionen stammen aus Ammoniumsalzen. Außerdem können diese hydrolysiblen Protonen in organischen Verbindungen auftreten, die protonierte Amingruppen enthalten. E.G. Ammoniumionen, Methylammoniumion, Ethylammoniumion, Aniliniumion usw.
Hydrolysible Protonen im Anion
Saure Salze können die hydrolysiblen Protonen im Anion enthalten. Beispiele sind Bisulfition, Dihydrogencitrat, Bioxalation usw. Diese Anionen enthalten Protonen, die schwach in Wasser dissoziiert werden.
Was ist ein einfaches Salz?
Basissalze sind ionische Verbindungen, die bei Auflösung im Wasser grundlegende Lösungen bilden können. Das bedeutet; Diese Salze können eine wässrige Lösung mit einem pH -Wert von mehr als 7 bilden.0. Im Allgemeinen kann ein Basissalz ein Wassermolekül deprotonieren und Hydroxidionen bilden, die die Basizität in der wässrigen Lösung verursachen können.

Abbildung 02: Natriumsulfid ist ein Basissalz
Einige Beispiele für Basissalze sind Natriumbicarbonat, Calciumcarbonat, Natriumacetat, Kaliumcyanid und Natriumsulfid. Diese Salze können mit Wasser reagieren und die Wassermoleküle dazu zwingen, ein Hydroxidion zu entfernen.
Was ist der Unterschied zwischen saurem Salz und Basissalz?
Der Schlüsselunterschied zwischen saurem Salz und Basissalz besteht darin, dass saure Salze eine Lösung bilden, die weniger als pH 7 ist.0 Wenn in Wasser gelöst wird, bilden Basissalze eine Lösung, die höher als pH 7 ist.0 Wenn es in Wasser aufgelöst wird. Ammoniumsalze, Natriumbisulfit und Calciumoxalat sind einige Beispiele für saure Salze, während Natriumbicarbonat, Calciumcarbonat, Natriumacetat, Kaliumcyanid und Natriumsulfid einige Beispiele für Basissalze sind.
Die folgende Infografik fasst den Unterschied zwischen saurem Salz und Basissalz zusammen.
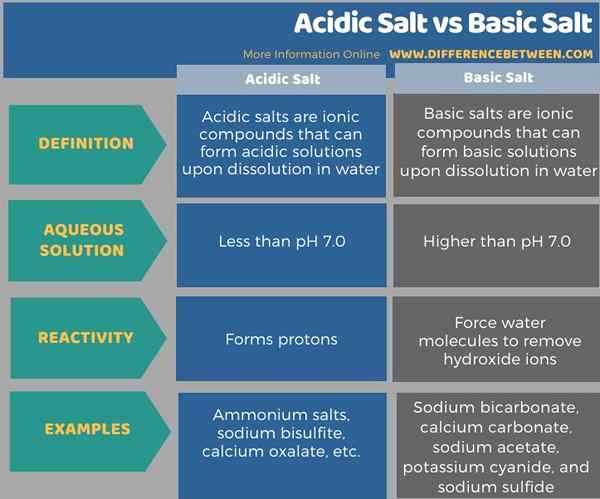
Zusammenfassung -saures Salz gegen Basissalz
Abhängig von der ionischen Zusammensetzung eines Salzes können die Eigenschaften und die Reaktivität bestimmt werden. Daher können wir ein Salz in drei Gruppen als saure Salze, Basissalze und neutrale Salze kategorisieren. Der Schlüsselunterschied zwischen saurem Salz und Basissalz besteht darin, dass saure Salze eine Lösung bilden, die weniger als pH 7 ist.0 Wenn in Wasser gelöst wird, bilden Basissalze eine Lösung, die höher als pH 7 ist.0 Wenn es in Wasser aufgelöst wird.
Referenz:
1. „Säure-Base-Eigenschaften von Salzen."Grengless Chemistry" Lumen, hier erhältlich.
2. “7.8: Säure-Base-Eigenschaften von Salzen.”Chemistry Libretexten, Libretexten, 3. Juni 2019, hier verfügbar.
3. „Säuresalz.Wikipedia, Wikimedia Foundation, 17. Oktober. 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Natrium Bisulfat" von Edgar181 - eigene Arbeit, Public Domain) über Commons Wikimedia
2. "Natriumsulfid -Nichtahydratkristalle" von Leiem - eigene Arbeit (CC BY -SA 4.0) über Commons Wikimedia


