Unterschied zwischen Aktivierungsenergie und Schwellenenergie
Der Schlüsselunterschied Zwischen Aktivierungsenergie und Schwellenenergie ist das die Die Aktivierungsenergie beschreibt den potentiellen Energieunterschied zwischen den Reaktanten und dem aktivierten Komplex, während die Schwellenenergie die Energie beschreibt, die von Reaktanten erforderlich ist, um erfolgreich miteinander zu kollidieren, um den aktivierten Komplex zu bilden.
Energie ist die Fähigkeit, zu arbeiten. Wenn es genügend Energie gibt, können wir diese Energie nutzen, um etwas Arbeit zu erledigen, die wir uns wünschen. In der Chemie kann diese Arbeit entweder eine chemische Reaktion oder eine Kernreaktion sein. Aktivierungsenergie und Schwellenergie sind zwei Begriffe, die wir in der Chemie verwenden, um zwei verschiedene Formen von Energie zu definieren.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Aktivierungsenergie
3. Was ist Schwellenenergie
4. Seite an Seite Vergleich - Aktivierungsenergie und Schwellenenergie in tabellarischer Form
5. Zusammenfassung
Was ist Aktivierungsenergie?
Aktivierungsenergie ist eine Energieform, die wir benötigen, um eine chemische oder nukleare Reaktion oder eine andere Reaktion zu aktivieren. In den meisten Fällen messen wir diese Energieform in der Einheit Kilojoule pro Maulwurf (kJ/mol). Diese Energieform ist die potentielle Energiebarriere, die eine chemische Reaktion durch Fortschreiten vermeidet. Dies bedeutet, dass es verhindert, dass die Reaktanten in die Produkte umgewandelt werden. Um eine chemische Reaktion in einem thermodynamischen System voranzutreiben, sollte das System eine hohe Temperatur erreichen, die ausreicht, um den Reaktanten eine Energie zu liefern, die entweder gleich oder größer ist als die Aktivierungsenergiebarriere.

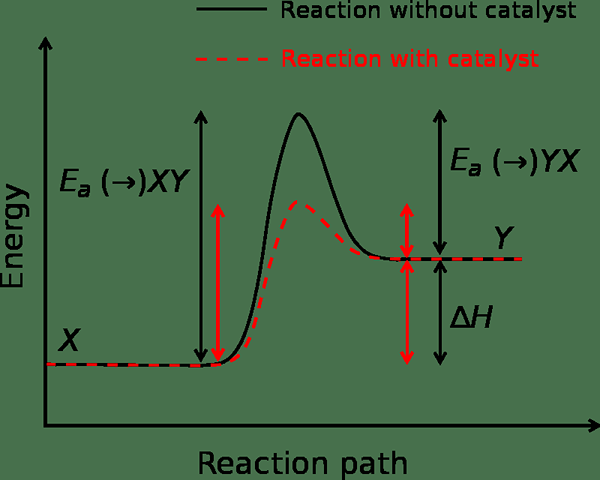
Abbildung 01: Reaktionsgeschwindigkeit in Abwesenheit und Gegenwart eines Katalysators
Wenn das System genug Energie bekommt, nimmt die Reaktionsgeschwindigkeit zu. In einigen Fällen nimmt die Reaktionsrate jedoch ab, wenn wir die Temperatur erhöhen. Dies ist auf die negative Aktivierungsenergie zurückzuführen. Wir können die Reaktionsrate und die Aktivierungsenergie unter Verwendung der Arrhenius -Gleichung berechnen. Es ist wie folgt:
K = ae-EA/(Rt)
Wo k ist der Reaktionsgeschwindigkeitskoeffizient, A ist der Frequenzfaktor für die Reaktion, R ist die universelle Gaskonstante und T die absolute Temperatur ist. Dann eA ist die Aktivierungsenergie.
Darüber hinaus sind Katalysatoren Substanzen, die die Aktivierungsenergiebarriere für eine Reaktion senken können. Dies geschieht, indem der Übergangszustand der Reaktion geändert wird. Darüber hinaus verbraucht die Reaktion den Katalysator nicht, während die Reaktion voranschreitet.
Was ist Schwellenenergie?
Die Schwellenenergie ist die minimale Energie, die ein Partikelpaar haben muss, um einer erfolgreichen Kollision zu erfahren. Dieser Begriff ist in der Teilchenphysik und nicht in der Chemie sehr nützlich. Hier sprechen wir über die kinetische Energie der Partikel. Diese Kollision von Partikeln bildet den aktivierten Komplex (Zwischenprodukt) einer Reaktion. Daher entspricht die Schwellenenergie der Summe der kinetischen Energie und Aktivierungsenergie. Daher ist diese Energieform immer gleich oder größer als die Aktivierungsenergie.
Was ist der Unterschied zwischen Aktivierungsenergie und Schwellenenergie?
Aktivierungsenergie ist eine Energieform, die wir benötigen, um eine chemische oder nukleare Reaktion oder eine andere Reaktion zu aktivieren. Es beschreibt den potentiellen Energieunterschied zwischen den Reaktanten und dem aktivierten Komplex. Darüber hinaus ist sein Wert immer gleich oder niedriger als die Schwellenenergie desselben thermodynamischen Systems. Die Schwellenenergie hingegen ist die minimale Energie, die ein Partikelpaar haben muss, um einer erfolgreichen Kollision zu unterziehen. Es beschreibt die Energie, die die Reaktanten benötigen, um erfolgreich miteinander zu kollidieren, um den aktivierten Komplex zu bilden. Darüber hinaus ist der Wert dieser Energie immer gleich oder größer als die Aktivierungsenergie desselben thermodynamischen Systems. Die folgende Infografik zeigt den Unterschied zwischen Aktivierungsenergie und Schwellenergie in tabellarischer Form.
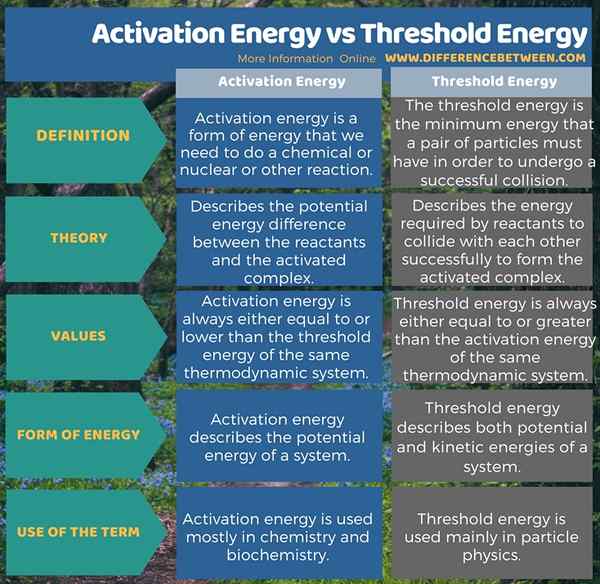
Zusammenfassung -Aktivierungsenergie gegen Schwellenenergie
Wir können sowohl Schwellenergie als auch Aktivierungsenergie für ein thermodynamisches System definieren. Der Schlüsselunterschied zwischen Aktivierungsenergie und Schwellenergie besteht darin, dass die Aktivierungsenergie die potentielle Energiedifferenz zwischen den Reaktanten und dem aktivierten Komplex beschreibt, während die Schwellenenergie die von den Reaktanten erforderliche Energie beschreibt, um erfolgreich miteinander zu kollidieren, um den aktivierten Komplex zu bilden.
Referenz:
1. "Aktivierungsenergie.Wikipedia, Wikimedia Foundation, 27. Juli 2018. Hier verfügbar
2. „Schwellenenergie.”Wikipedia, Wikimedia Foundation, 9. August. 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1."Aktivierungsenergie" (Public Domain) über Commons Wikimedia


