Unterschied zwischen Adhäsion und Zusammenhalt

Der Schlüsselunterschied Zwischen Adhäsion und Zusammenhalt ist das Adhäsion ist die Anziehungskraft zwischen Substanzen oder Molekülen, die nicht ähnlich sind, während Kohäsion die Anziehungskraft zwischen den Molekülen oder Substanzen ist, die ähnlich sind.
Es gibt verschiedene Phänomene, um die Dinge zu erklären, die wir in unserem täglichen Leben beobachten. Obwohl wir uns manchmal nicht auf diese kleinen Details konzentrieren, sind sie diejenigen, die dazu beitragen, das Leben auf der Erde zu halten. Adhäsion und Zusammenhalt sind zwei solche Phänomene. Obwohl sie ähnlich klingen, sind sie völlig unterschiedliche Begriffe.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Haftung
3. Was ist Zusammenhalt
4. Seite an Seitenvergleich - Adhäsion gegen Kohäsion in tabellarischer Form
5. Zusammenfassung
Was ist Haftung?
Adhäsion ist die attraktive Kraft zwischen zwei Arten von Molekülen, die sich voneinander unterscheiden. Zum Beispiel ist die Anziehungskraft zwischen den Wassermolekülen mit den Wänden der Xylemgefäße die Adhäsion. Wegen dieser Kraft kann Wasser in Pflanzen durch das Xylem fliegen. Darüber hinaus sind dies intermolekulare Kräfte.
Es gibt fünf Mechanismen, um den Mechanismus der Adhäsion als Follows zu erklären:
- Mechanische Haftung
- Chemische Haftung
- Dispersive Haftung
- Elektrostatische Haftung
- Diffusive Adhäsion
In mechanischer Haftung hält das Klebstoff die Oberfläche durch Füllen in die darin enthaltenen Löcher oder Poren. Bei chemischer Adhäsion bilden sich chemische Bindungen und sie können entweder eine ionische oder kovalente Bindung sein. Wenn die Bindungen ionisch sind, können Elektronen spenden oder anziehen, sonst kann die Elektronenfreigabe in kovalenter Bindung vorhanden sein.
Abgesehen von diesen können intermolekulare Bindungen wie Wasserstoffbrückenbindungen am Halten von zwei Materialien teilnehmen. Wenn die beiden Materialien aufgrund von Van der Waals -Kräften zusammengehalten werden, können wir diesen Mechanismus durch dispersive Haftung erklären.
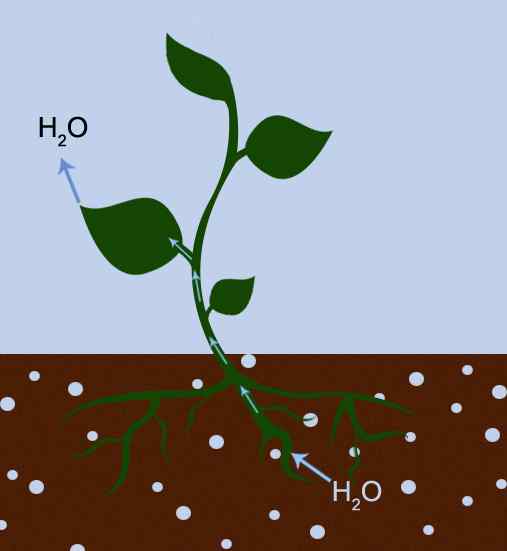
Abbildung 01: Die Transpiration ist sowohl auf die Adhäsion als auch auf den Zusammenhalt zurückzuführen
Wenn es in einem Molekül eine leichte (dauerhafte oder zeitliche) Ladung Trennung gibt, ist das Molekül polarisiert geworden. Die entgegengesetzten Gebühren ziehen sich gegenseitig an; Daher gibt es attraktive Kräfte zwischen den Molekülen. Ein Elektronenübergang in leitfähigem Material kann elektrische Ladungsunterschiede verursachen. Die Ladungsunterschiede können zu attraktiven elektrostatischen Kräften zwischen Materialien führen. Wir nennen es elektrostatische Haftung.
Wenn zwei Arten von Molekülen ineinander löslich sind, können sie sich in die andere Oberfläche bewegen; Somit führt es zu einer diffusiven Adhäsion. Die Stärke der Adhäsionskräfte hängt vom Mechanismus ab; Wie es passiert. Wenn beispielsweise die Kontaktoberfläche sehr größer ist, ist die Stärke der Van der Waals -Kräfte höher. Daher ist die Stärke der dispersiven Adhäsionskräfte höher.
Was ist Zusammenhalt?
Zusammenhalt ist die intermolekulare Kraft zwischen zwei ähnlichen Molekülen. Zum Beispiel haben Wassermoleküle intermolekulare Anziehungskräfte zwischen sich. Diese Eigenschaft von Wasser ermöglicht es Wassermolekülen, mit Konsistenz zu reisen. Wir können die Form der Regentropfen oder die Existenz von Wassertröpfchen und nicht einzelne Moleküle durch den Zusammenhalt erklären.

Abbildung 02: Bildung von Wasserabfällen aufgrund des Zusammenhalts
Darüber hinaus ist die Wasserstoffbrückenbindungsfähigkeit von Wassermolekülen der Hauptgrund für die Kohäsionskräfte von Wassermolekülen. Jedes Wassermolekül kann vier Wasserstoffbrückenbindungen mit anderen Wassermolekülen bilden. Somit ist die Sammlung der Anziehungskräfte viel stärker. Elektrostatische Kräfte und Van -der -Waals -Kräfte zwischen ähnlichen Molekülen verursachen auch Adhäsion. Die Adhäsion aufgrund von Van der Waals -Kräften ist jedoch etwas schwächer.
Was ist der Unterschied zwischen Adhäsion und Zusammenhalt?
Adhäsion ist die attraktive Kraft zwischen zwei Arten von Molekülen, die sich voneinander unterscheiden, und Kohäsion ist die intermolekulare Kraft zwischen zwei ähnlichen Molekülen. Daher besteht der Hauptunterschied zwischen Adhäsion und Zusammenhalt darin.
Ein weiterer signifikanter Unterschied zwischen Adhäsion und Zusammenhalt besteht darin, dass die Adhäsion elektrostatische Anziehungen umfasst, während der Zusammenhalt von Van der Waal -Kräfte und Wasserstoffbrückenbindung umfasst. Zum Beispiel liegt der Zusammenhalt zwischen zwei Wassermolekülen und die Adhäsion liegt zwischen Wassermolekülen und den Wänden von Xylemgefäßen.

Zusammenfassung -Adhäsion gegen Kohäsion
Adhäsion und Zusammenhalt sind zwei Arten von intramolekularen Kräften. Der Schlüsselunterschied zwischen Adhäsion und Kohäsion besteht darin.
Referenz:
1. Libretexten. „Kohäsive und Klebstoffkräfte.”Chemistry Libretexten, National Science Foundation, 26. November. 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.”9897320755" von Zappys Technology Solutions (CC von 2.0) über Flickr
2."Drops i" von Staffan Enbom aus Finnland (CC von 2.0) über Commons Wikimedia


