Unterschied zwischen Alkali und Basis

Der Schlüsselunterschied Zwischen Alkali und Basis ist das die Gruppe -1.
Wir verwenden oft das Wort alkali austauschbar, um hoch grundlegende Lösungen und Alkali -Metalle anzusprechen. In diesem Zusammenhang wird Alkali auf die Alkali -Metalle der Gruppe 1 der periodischen Elementtabelle verwiesen. Der Begriff Basis kann jedoch auf jedes Element, Molekül, Ion usw. verweisen. das haben grundlegende Eigenschaften.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Alkali
3. Was ist Basis
4. Seite an Seite Vergleich - Alkali vs Basis in tabellarischer Form
5. Zusammenfassung
Was ist Alkali?
Alkali ist ein Begriff, den wir üblicherweise für die Metalle in Gruppe 1 der Periodenzüchter verwenden. Diese sind auch als Alkali -Metalle bekannt. Obwohl H auch in dieser Gruppe ist, ist es etwas anders; Es hat ein Verhalten, das sich von anderen Mitgliedern dieser Gruppe unterscheidet. Daher sind Lithium (Li), Natrium (Na), Kalium (K), Rubidium (RB), Cäsium (CS) und Francium (FR) Mitglieder dieser Gruppe.
Alkali -Metalle sind weiche, glänzende, silbrige Farbmetalle. Sie alle haben nur ein Elektron in ihrer Außenhülle, und sie entfernen gerne und bilden +1 Kationen. Wenn die äußeren Elektronen aufgeregt werden, kommt sie in den Grundzustand zurück, während sie Strahlung im sichtbaren Bereich abgibt. Die Emission dieses Elektrons ist einfach; Somit sind Alkali -Metalle sehr reaktiv. Darüber hinaus erhöht sich die Reaktivität in der Gruppe 1 der Periodenverkehrstabelle.

Abbildung 01: Natriumhydroxid - Ein Hydroxid eines Alkali -Metalls
Diese Metalle bilden ionische Verbindungen mit anderen elektronegativen Atomen. Genauer gesagt bezieht sich der Begriff Alkali auf das Carbonat oder das Hydroxid eines Alkali -Metalls. Sie haben auch grundlegende Eigenschaften. Sie sind bitter im Geschmack, rutschig und reagieren mit Säuren, um sie zu neutralisieren.
Was ist Basis?
Definitionen
Verschiedene Wissenschaftler definierten „Basis“ unterschiedlich. Arrhenius definiert es als eine Substanz, die OH-Ionen für die Lösung spendet. Bronsted-Lowry definiert eine Basis als Substanz, die ein Proton akzeptieren kann. Laut Lewis ist jeder Elektronendonor eine Basis. Gemäß der Arrhenius -Definition sollte eine Verbindung ein Hydroxidanion und die Fähigkeit haben, sie als Hydroxidion zu spenden, um eine Basis zu sein. Laut Lewis und Bronsted-Lowry kann es jedoch Moleküle geben, die keine Hydroxide besitzen, aber als Basis wirken können. Zum Beispiel NH3 ist eine Lewis -Basis, weil es das Elektronenpaar auf Stickstoff spenden kann. Ebenso na2CO3 ist eine Bronsted-Lowry-Basis ohne Hydroxidgruppen, kann aber Wasserstoffe akzeptieren.
Eigenschaften
Basen haben eine rutschige Seife wie Gefühl und einen bitteren Geschmack. Sie reagieren leicht mit Säuren, die Wasser- und Salzmoleküle produzieren. Ätznatronen, Ammoniak und Backpulver sind einige der gemeinsamen Basen. Wir können diese Verbindungen in zwei Gruppen kategorisieren, abhängig von ihrer Fähigkeit, Hydroxidionen zu dissoziieren und zu produzieren. Sie sind starke und schwache Basen. Starke Basen wie Naoh, Koh, können in einer Lösung vollständig ionisieren, um Ionen zu geben. Schwache Basen wie NH3 teilweise dissoziieren und weniger Mengen an Hydroxidionen geben.

Abbildung 02: Bariumhydroxid - eine Basis des Elements der Gruppe 2 Element Barium
Weiter, kB ist die Basis -Dissoziationskonstante. Es zeigt die Fähigkeit an, Hydroxidionen einer schwachen Basis zu verlieren. Um zu überprüfen, ob eine Substanz eine Basis ist oder nicht, können wir mehrere Indikatoren wie Lackmuspapier oder pH -Papier verwenden. Diese Verbindungen zeigen einen pH -Wert von mehr als 7 und er wird roter Lackmus in Blau.
Was ist der Unterschied zwischen Alkali und Basis?
Gruppe -1 -Metalle werden als Alkali oder genauer gesagt, ihre Carbonate und Hydroxide werden als Alkali bezeichnet. Sie haben jedoch grundlegende Eigenschaften; Somit sind sie eine Untergruppe von Basen. Der Schlüsselunterschied zwischen Alkali und Basi. Daher sind alle Alkalis Basen, aber nicht alle Basen sind Alkalis. Ein weiterer signifikanter Unterschied zwischen Alkali und Basi.
Die folgende Infografik zum Unterschied zwischen Alkali und Basis zeigt diese Unterschiede in der tabellarischen Form.
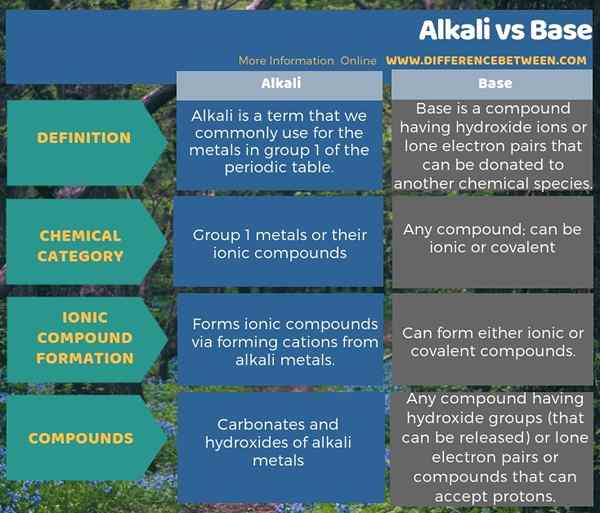
Zusammenfassung -Alkali gegen Basis
Wir verwenden oft die beiden Begriffe Alkali und Basis austauschbar, aber es sind zwei verschiedene Begriffe. Der Schlüsselunterschied zwischen Alkali und Basi.
Referenz:
1. Britannica, die Herausgeber von Encyclopaedia. "Alkali.”Encyclopædia Britannica, Encyclopædia Britannica, Inc., 14. Januar. 2014. Hier verfügbar
2. „Basis (Chemie).Wikipedia, Wikimedia Foundation, 27. November. 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1."Natriumhydroxidbild" von Walkerma - eigene Arbeit (Public Domain) über Commons Wikimedia
2.”Ba (OH) 2 OctaHydrate” von Leiem - eigene Arbeit, (CC BY -SA 4.0) über Commons Wikimedia


