Unterschied zwischen Allotropen und Isotopen
Der Schlüsselunterschied Zwischen Allotropen und Isotopen befindet sich das Allotrope werden auf molekularer Ebene berücksichtigt, während Isotope auf atomarer Ebene berücksichtigt werden.
Es gibt ungefähr 118 Elemente in der Periodenzüchter gemäß ihrer Atomzahl. Ein Element ist eine chemische Substanz, die nur aus einer einzigen Art von Atomen besteht; Daher sind sie rein. Allotrope sind unterschiedliche Formen derselben Verbindung, während Isotope unterschiedliche Formen desselben Elements sind.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind Allotrope
3. Was sind Isotope?
4. Seite an Seite Vergleich - Allotrope vs Isotope in tabellarischer Form
5. Zusammenfassung
Was sind Allotrope?
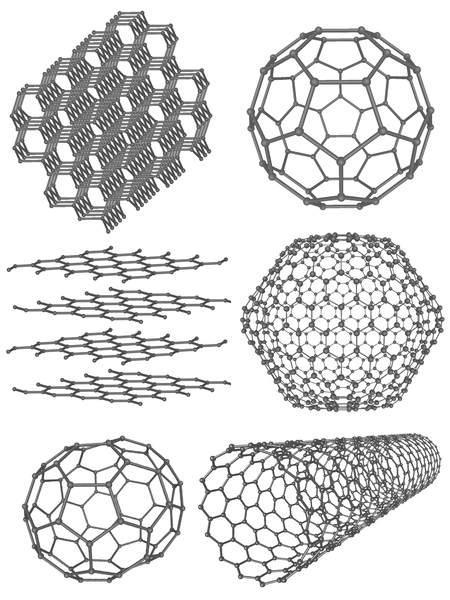
Allotrope sind unterschiedliche Formen des gleichen Elements auf der molekularen Ebene. Sie zeigen unterschiedliche physikalische Eigenschaften. Unter allen chemischen Elementen sind Kohlenstoff, Sauerstoff, Schwefel und Phosphor die Hauptelemente mit Allotrömen. Carbon hat eine große Anzahl von Allotrömen. Die acht Kohlenstofflegropen unterscheiden sich weitgehend voneinander. Zum Beispiel ist Diamond das stärkste Allotrop von Kohlenstoff, während Graphit weniger stark ist. Kohlenstoffnanoröhren, Fulleren und amorpher Kohlenstoff sind einige andere Kohlenstofflokale.

Abbildung 1: Kohlenstoffallotrope
Für den Elementsauerstoff gibt es zwei gemeinsame Allotröme als O2 und O3. O2 ist reichlich vorhanden als O3. Normalerweise sind in der Natur einige Allotrope aufgrund ihrer Stabilität häufiger als andere. Phosphor hat drei Allotrope als rot, weiß und schwarzer Phosphor. Von diesen sind rot und weiße Phosphor am häufigsten. Allotrope unterscheiden sich aufgrund der Atomanordnung, der Anzahl der Atome usw. voneinander.
Was sind Isotope??
Isotope sind verschiedene Formen von Atomen desselben chemischen Elements. Sie unterscheiden sich voneinander, da sie eine andere Anzahl von Neutronen haben. Da die Neutronenzahl unterschiedlich ist, unterscheidet sich auch ihre Massenzahl.
Die Isotope desselben Elements haben jedoch die gleiche Anzahl von Protonen und Neutronen. Unterschiedliche Isotope sind in unterschiedlichen Mengen vorhanden, und wir können dies als prozentualer Wert angeben, der als relative Häufigkeit bezeichnet wird. Zum Beispiel hat Wasserstoff drei Isotope wie Protium, Deuterium und Tritium. Ihre Anzahl von Neutronen und relativen Häufigkeiten ist wie folgt.

Abbildung 2: verschiedene Isotope des Wasserstoffs des chemischen Elements
Die Anzahl der Neutronen, die ein Kern halten kann, unterscheidet sich von Element zu Element. Unter diesen Isotopen sind nur einige stabil. Zum Beispiel hat Sauerstoff drei stabile Isotope und Tin hat zehn stabile Isotope. Meistens haben einfache Elemente die gleiche Neutronenzahl wie die Protonennummer. Aber in schweren Elementen gibt es mehr Neutronen als Protonen. Die Anzahl der Neutronen ist wichtig, um die Stabilität der Kerne auszugleichen. Wenn die Kerne zu schwer sind, werden sie instabil; Daher werden diese Isotope radioaktiv. Zum Beispiel emittiert 238u Strahlung und Zerfälle auf viel kleinere Kerne. Isotope können aufgrund ihrer unterschiedlichen Massen unterschiedliche Eigenschaften haben. Zum Beispiel können sie unterschiedliche Spins haben; Somit unterscheiden sich ihre NMR -Spektren. Ihre Elektronenzahl ist jedoch ähnlich und führt zu ähnlichem chemischem Verhalten.
Was ist der Unterschied zwischen Allotropen und Isotopen?
Allotrope sind unterschiedliche Formen des gleichen Elements auf der molekularen Ebene. Isotope sind verschiedene Formen von Atomen desselben chemischen Elements. Der Hauptunterschied zwischen Allotröpern und Isotopen besteht darin. Darüber hinaus besteht ein weiterer Unterschied zwischen Allotropen und Isotopen darin, dass sich die Allotröpe voneinander unterscheiden, wie Atome angeordnet sind, während sich Isotope in der Anzahl der Neutronen voneinander unterscheiden.
Die folgende Infografik zeigt weitere Details zum Unterschied zwischen Allotröpern und Isotopen.

Zusammenfassung -Allotrope gegen Isotope
Obwohl die Begriffe Allotrope und Isotopen ähnlich klingen, unterscheiden sie sich je nach ihren Bedeutungen sehr voneinander. Der Hauptunterschied zwischen Allotröpern und Isotopen besteht darin.
Referenz:
1. Helmenstine, Anne Marie, „Allotrope Definition und Beispiele.”Thoughtco, Jan. 13, 2019, hier erhältlich.
2. Helmenstine, Anne Marie, „Isotopes Definition und Beispiele in der Chemie.”Thoughtco, Oktober. 22, 2018, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Allotrope of Carbon" von Mstroeck (Talk) (Uploads) - eigene Arbeit (CC BY -SA 3.0) über Commons Wikimedia


