Unterschied zwischen Ammoniak und Ammoniumhydroxid
Der Schlüsselunterschied Zwischen Ammoniak und Ammoniumhydroxid ist das Ammoniak tritt als Gas auf, während Ammoniumhydroxid bei Raumtemperatur als Flüssigkeit auftritt.
Ammoniak und Ammoniumhydroxid haben viele Verwendungszwecke für uns. Wir alle wissen, dass Ammoniak mit einer chemischen Formel NH3 ein stechend riechendes Gas ist. Wenn es mit Wasser in Kontakt kommt, erhalten wir Ammoniumhydroxid. Daher nennen wir manchmal Ammoniumhydroxid als „Ammoniaklösung“.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Ammoniak
3. Was ist Ammoniumhydroxid
4. Seite für Seitenvergleich - Ammoniak gegen Ammoniumhydroxid in tabellarischer Form
5. Zusammenfassung
Was ist Ammoniak?
Ammoniak ist eine gasförmige Substanz mit der chemischen Formel NH3. Es ist eine anorganische Verbindung und auch das einfachste Pnictogen -Hydrid. Es ist ein farbloses Gas, hat aber einen scharfen, irritierenden Geruch. Darüber hinaus ist der IUPAC -Name Ammoniak Azane.
Einige wichtige chemische Fakten zu dieser Substanz sind wie folgt:
- Die chemische Formel ist NH3
- Molmasse ist 17.03 g/mol.
- Erscheint als farbloses Gas
- Schmelzpunkt ist –77.73 ° C
- Siedepunkt ist –33.34 ° C
Wenn das Auftreten dieser Verbindung berücksichtigt wird, tritt sie natürlich jedoch in Spurenmengen auf. Das ist ein Produkt von stickstoffhaltigem Tier und Gemüsematerie. Manchmal finden wir auch Ammoniak im Regenwasser. In unserem Körper sezernieren Nieren Ammoniak, um überschüssige Säure zu neutralisieren.

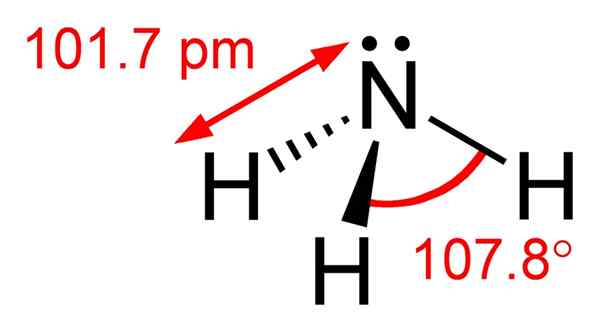
Abbildung 01: Chemische Struktur des Ammoniakmoleküls
In der chemischen Struktur des Ammoniakmoleküls hat es ein Stickstoffatom, das an drei Wasserstoffatome gebunden ist. Da es fünf Elektronen in der äußersten Elektronenhülle des Stickstoffs gibt, gibt es ein einsames Elektronenpaar am Stickstoffatom des Ammoniakmoleküls. Daher ist die Geometrie des Ammoniakmoleküls trigonaler Pyramiden. Darüber hinaus können wir diese Verbindung leicht verflüssigen. Dies liegt daran, dass es in der Lage ist, Wasserstoffbrückenbindungen zwischen Ammoniakmolekülen zu bilden.
Was ist Ammoniumhydroxid?
Ammoniumhydroxid ist eine flüssige Substanz mit der chemischen Formel NH4OH. Es ist auch eine anorganische Verbindung. Wir können es als Ammoniaklösung bezeichnen, da diese Verbindung bildet, wenn Ammoniakgas mit Wasser reagiert. Deshalb können wir es als NH bezeichnen3(aq). Obwohl der Name Ammoniumhydroxid die Existenz einer alkalischen Verbindung impliziert, ist es tatsächlich unmöglich, die chemische Verbindung Ammoniumhydroxid zu isolieren.
Abbildung 02: Ball- und Stickmodell für Ammoniumionen
Einige wichtige chemische Fakten über diese Verbindung sind wie folgt:
- Die chemische Formel ist NH4OH
- Molmasse ist 35.04 g/mol.
- Erscheint als farblose Flüssigkeit.
- Es hat einen sehr scharfen Geruch.
- Schmelzpunkt ist –57.5 ° C
- Siedepunkt ist 37.7 ° C
Bei der Betrachtung der Anwendungen dieser Flüssigkeit ist sie als Haushaltsreiniger als Alkylaminvorläufer für Wasserbehandlungszwecke nützlich, und viele andere Anwendungen sind da.
Die Reaktion für die Bildung dieser Verbindung ist wie folgt:
NH3 + H2O -> nh4+ + OH-
Was ist der Unterschied zwischen Ammoniak und Ammoniumhydroxid?
Ammoniak ist eine gasförmige Substanz mit der chemischen Formel NH3, während Ammoniumhydroxid eine flüssige Substanz mit der chemischen Formel NH ist4OH. Daher besteht der Hauptunterschied zwischen Ammoniak und Ammoniumhydroxid in ihren physischen Zuständen. Das heißt, der Unterschied zwischen Ammoniak und Ammoniumhydroxid besteht darin, dass Ammoniak als Gas auftritt, während Ammoniumhydroxid als Flüssigkeit bei Raumtemperatur auftritt. Da sich Ammoniumhydroxid beim Lösen von Ammoniakgas in Wasser bildet, nennen wir diese Verbindung auch als Ammoniaklösung oder flüssiges Ammoniak. Ein weiterer Unterschied zwischen Ammoniak und Ammoniumhydroxid besteht darin, dass Ammoniak wasserfrei ist, während Ammoniumhydroxid wasserd ist.

Zusammenfassung -Ammoniak gegen Ammoniumhydroxid
Ammoniumhydroxid bildet sich aus der Auflösung von Ammoniakgas in Wasser. Daher ist Ammoniumhydroxid tatsächlich eine wässrige Lösung von Ammoniak. Der Hauptunterschied zwischen Ammoniak und Ammoniumhydroxid besteht jedoch darin, dass Ammoniak als Gas auftritt, während Ammoniumhydroxid als Flüssigkeit bei Raumtemperatur auftritt.
Referenz:
1. "Ammoniak.Wikipedia, Wikimedia Foundation, 16. Oktober. 2018. Hier verfügbar
2. "Ammoniaklösung.Wikipedia, Wikimedia Foundation, 17. Oktober. 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.Ammoniakdimensionen-from-Greenwood & Earnshaw-2D “von Ben Mills-eigene Arbeit, (Public Domain) über Commons Wikimedia
2."Ammonium-3d-Balls" (Public Domain) über Commons Wikimedia


