Unterschied zwischen Antibonding und Nichtbindung
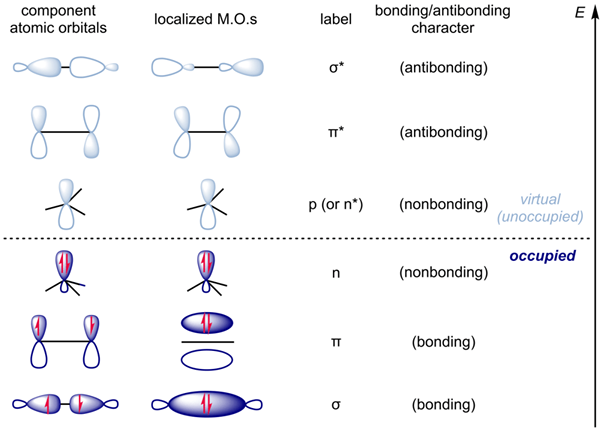
Der Schlüsselunterschied zwischen Antibinding und Nichtbindung ist das Antibindungsorbitale erhöhen die Energie eines Moleküls, während nichtbindende Orbitale die Energie eines Moleküls nicht verändern.
Die Begriffe, die sich gegen die molekulare Orbitalentheorie verhalten und nicht gebunden werden. Nach dieser Theorie sind diese Orbitale hybride Orbitale, die sich aufgrund der Überschneidung anderer Orbitale bilden.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Antibonding?
3. Was ist nicht gebunden
4. Seite an Seitenvergleich - Antibonding gegen nicht bindend in tabellarischer Form
5. Zusammenfassung
Was ist Antibonding??
Antibinding molekulare Orbitale sind Orbitale, die Elektronen außerhalb der Region zwischen zwei Atomkern enthalten. Elektronen in den Antibindungsorbitalen verringern die Stabilität eines Moleküls, da diese Elektronen die meiste Zeit außerhalb der Atomkerne verbringen. Daher ist die Elektronendichte der antibindenden molekularen Orbitale im Vergleich zu den molekularen Bindungsorbitalen weniger.
Antibinding molekulare Orbitale haben eine höhere Energie als die von atomaren Orbitalen und molekularen Bindungsorbitalen. Dies liegt daran, dass die Elektronen in diesen Orbitalen nicht zur Verringerung der Abstoßung zwischen zwei Atomkern beitragen. Daher ist die Stabilität von Verbindungen mit Elektronen in den Antibindungsmolekülorbitalen niedriger. In stabilen Verbindungen ist das Vorhandensein von Elektronen in antibindenden molekularen Orbitalen jedoch nicht oder weniger. Darüber hinaus bestimmt die räumliche Anordnung von Antibindungsmolekülorbitalen nicht die Form oder die Geometrie eines Moleküls.

Gemäß dem obigen Bild ist die Elektronendichte im Bindungsmolekülorbital dem des Antibindungsmolekülorbitals gleich. Daher ist es ein sehr instabiles Molekül. Daher existiert HE2 -Molekül nicht. Das Antibonding Molekular -Orbital wird als σ* angegeben.
Was ist nicht gebunden?
Das nicht gebundene Orbital ist das molekulare Orbital, bei dem die Zugabe oder Entfernung von Elektronen die Bindungsordnung zwischen Atomen nicht erhöht oder verringert. Wir bezeichnen dieses Orbital oft mit „N“. Diese Orbitale ähneln den einzigen Elektronenpaaren in Lewis -Strukturen.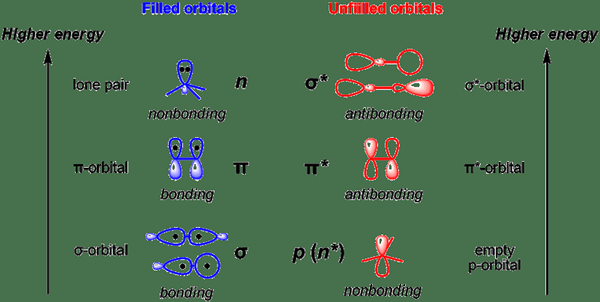
Darüber hinaus besteht die Energie eines nicht gebundenen Orbitals zwischen der Antibone -Orbitalenergie und dem Bindungsorbital.
Was ist der Unterschied zwischen Antibonding und Nichtbindung?
Antibindungs- und nicht gebundene Orbitale sind molekulare Orbitale. Der Hauptunterschied zwischen Antibinding und Nichtbindung besteht darin, dass Antibindungsorbitale die Energie eines Moleküls erhöhen, während nicht -gebundene Orbitale die Energie eines Moleküls nicht verändern. Darüber hinaus tendiert das Vorhandensein von Antibinding -Orbitalen dazu, das Molekül zu unterbinden, während nichtbindende Orbitale keine Auswirkung auf die Stabilität des Moleküls haben.
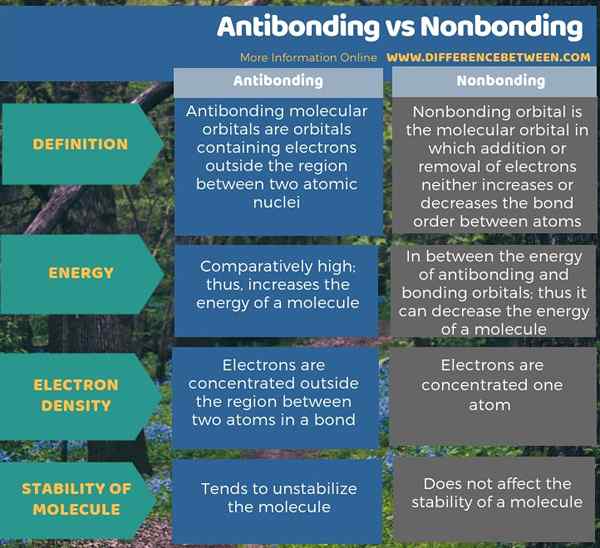
Zusammenfassung -Antibonding im Vergleich zu nicht gebundenen
Antibindungs- und nicht gebundene Orbitale sind molekulare Orbitale. Der Hauptunterschied zwischen Antibinding und Nichtbindung besteht darin, dass Antibindungsorbitale die Energie eines Moleküls erhöhen, während nicht -gebundene Orbitale die Energie eines Moleküls nicht verändern.
Referenz:
1. Helmenstine, Anne Marie. „Antibonding Orbital Definition.”Thoughtco, Jul. 3, 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Localized Mos" von Alsosaid1987 - eigene Arbeit (CC BY -SA 4.0) über Commons Wikimedia
2. "Cartoon lokalisierte molekulare Orbitale" von Alsosaid1987 - eigene Arbeit (CC BY -SA 4.0) über Commons Wikimedia


