Unterschied zwischen Atommasse und durchschnittlicher Atommasse
Der Schlüsselunterschied Zwischen Atommasse und durchschnittlicher Atommasse ist das die Atommasse ist die Masse eines Atom.
Wir verwenden oft die Begriffe Atommasse und durchschnittliche Atommasse austauschbar; Es sind jedoch zwei verschiedene Begriffe.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Atommasse
3. Was ist durchschnittliche Atommasse
4. Seite an Seitenvergleich - Atommasse gegen durchschnittliche Atommasse in tabellarischer Form
5. Zusammenfassung
Was ist Atommasse?
Atommasse ist die Gesamtmasse der Nukleonen, die im Kern eines Atoms vorhanden sind. Ein Nukleon ist entweder ein P7P oder ein Neutron. Atommasse ist daher die Gesamtmasse der im Kern vorhandenen Protonen und Neutronen. Obwohl auch Elektronen in Atomen vorhanden sind, wird die Masse der Elektronen in den Berechnungen nicht verwendet, da die Elektronen so klein sind und im Vergleich zu Protonen und Neutronen eine vernachlässigbare Masse aufweisen.
Anders als in der relativen Atommasse berechnen wir hier die Masse jedes Atoms, ohne einen Durchschnittswert zu berechnen. Daher erhalten wir unterschiedliche Werte für Atommassen verschiedener Isotope. Das liegt daran, dass sich die Anzahl der in Isotopen desselben Elements vorhanden.

Betrachten wir ein Beispiel:
Die atomare Wasserstoffmasse = 2
Die Atommasse von Wasserstoff-2 (Deuterium) Isotop wird also wie folgt berechnet.
Die Anzahl der Protonen im Kern = 1
Die Anzahl der Neutronen im Kern = 1
Daher die Atommasse von Wasserstoff = (1 Amu + 1 Amu) = 2 Amu
Hier wird die Atommasse von der Einheit AMU (Atommasseneinheiten) gegeben. Ein Proton oder ein Neutron hat eine Masse von 1 Amu.
Was ist durchschnittliche Atommasse?
Die durchschnittliche Atommasse ist die Masse eines Atoms eines bestimmten chemischen Elements, berechnet durch Berücksichtigung der Isotope dieses Elements. Darin hängt der Massenwert von der natürlichen Häufigkeit eines chemischen Elements ab.
Es gibt zwei Schritte, um die durchschnittliche Atommasse zu berechnen.
- Multiplizieren Sie die Atommasse jedes Isotops von der natürlichen Häufigkeit (die Häufigkeit als Prozentsatz nehmen) getrennt.
- Fügen Sie die erhaltenen Werte zusammen hinzu, um die durchschnittliche Atommasse zu erhalten.
Betrachten wir ein Beispiel:
Es gibt zwei Isotope Kohlenstoff wie Carbon-12 und Carbon-13. Ihre Fülle beträgt 98% bzw. 2. Dann können wir die durchschnittliche Atommasse von Kohlenstoff anhand einer Berechnung bestimmen. Hier müssen wir die Atommassen jedes Isotops mit dem Häufigkeitswert multiplizieren. Dann müssen wir die Häufigkeit als zwei Dezimalwert annehmen, nicht als Prozentsatz. Als nächstes können wir die erhaltenen Werte hinzufügen.
Carbon-12: 0.98*12 = 11.76
Carbon-13: 0.02*13 = 0.26
Dann beträgt die durchschnittliche Atommasse von Kohlenstoff = 11.76+0.26 = 12.02 g/mol.
Was ist der Unterschied zwischen Atommasse und durchschnittlicher Atommasse?
Obwohl der Begriff Atommasse und durchschnittliche Atommasse ähnlich klingen, sind sie zwei verschiedene Begriffe. Der Schlüsselunterschied zwischen Atommasse und durchschnittlicher Atommasse besteht darin, dass die Atommasse die Masse eines Atoms ist, während die durchschnittliche Atommasse die Masse eines Atoms eines bestimmten chemischen Elements ist, das durch Berücksichtigung der Isotope dieses Elements berechnet wird. Der Begriff Atommasse bezieht sich auf die Masse eines einzelnen Atoms, während der Begriff durchschnittliche Atommasse auf eine Masse eines chemischen Elements bezieht.
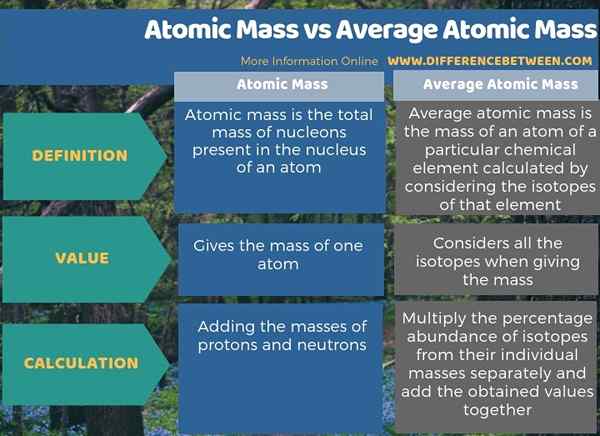
Zusammenfassung -Atommasse gegen durchschnittliche Atommasse
Atommasse bezieht sich auf die Masse eines einzelnen Atoms, aber die durchschnittliche Atommasse bezieht sich auf die durchschnittliche Masse eines Atoms eines bestimmten chemischen Elements. Daher besteht der Hauptunterschied zwischen Atommasse und durchschnittlicher Atommasse darin, dass die Atommasse die Masse eines Atoms ist, während die durchschnittliche Atommasse die Masse eines Atoms eines bestimmten chemischen Elements ist, das durch Berücksichtigung der Isotope dieses Elements berechnet wird.
Referenz:
Helmenstine, Anne Marie. „Wie man die Atommasse berechnet.”Thoughtco, August. 21, 2019, hier erhältlich.
Helmenstine, Anne Marie. „Wie man die Atommasse berechnet.”Thoughtco, August. 21, 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. „Stilisiertes Atom mit drei BOHR -Modellbahnen und stilisierten Kern“ durch SVG durch Abläufe. Wiederholung und Bügel ein paar Störungen von Rainer Klute. - Eigene Arbeit basierend auf: Bild: stilisiertes Lithiumatom.PNG von Halfdan (CC BY-SA 3.0) über Commons Wikimedia


