Unterschied zwischen Atomgewicht und Massenzahl
Der Schlüsselunterschied Zwischen Atomgewicht und Massenzahl ist das Atomgewicht ist die durchschnittliche Masse, die unter Berücksichtigung aller Isotope berechnet wird, während die Massenzahl die Masse eines bestimmten Isotops ist.
Wir können Atome durch ihre Atomnummern und Massenzahlen charakterisieren. In der Periodenzüchter sind Atome nach ihrer Atomzahl angeordnet. Die Massenzahl eines Elements hängt mit seiner Masse zusammen. Es gibt jedoch nicht die genaue Masse des Atoms. Atomgewicht ist eine weitere Möglichkeit, das Gewicht der Atome auszudrücken, aber dies unterscheidet sich von der Atommasse. Es ist jedoch wichtig, die Bedeutung dieser Terminologien getrennt zu ermitteln, da sie große Unterschiede in den Messungen machen können, wenn wir sie austauschbar verwenden.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Atomgewicht
3. Was ist Massenzahl
4. Seite für Seitenvergleich -Atomgewicht gegen Massenzahl in tabellarischer Form
5. Zusammenfassung
Was ist Atomgewicht?
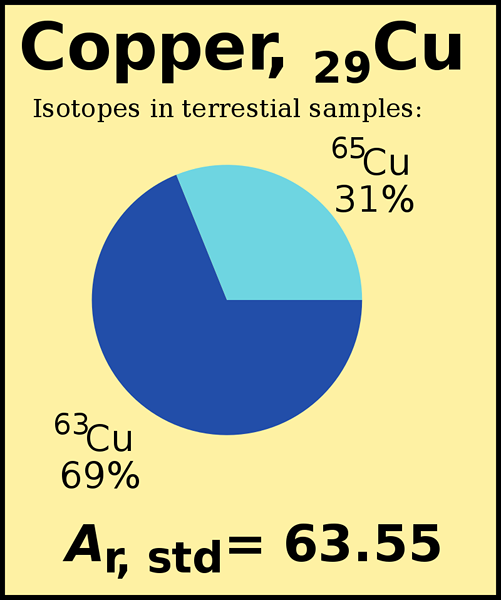
Atome enthalten hauptsächlich Protonen, Neutronen und Elektronen. Atommasse ist einfach die Masse eines Atoms. Die meisten Atome in der Periodenzüchter haben zwei oder mehr Isotope. Isotope unterscheiden sich voneinander, indem sie eine andere Anzahl von Neutronen haben, obwohl sie die gleiche Menge an Protonen und Elektronen haben. Da ihre Neutronenmenge unterschiedlich ist, hat jedes Isotop eine andere Atommasse. Atomgewicht ist das durchschnittliche Gewicht, das wir unter Berücksichtigung aller Massen von Isotopen berechnen. Jedes Isotop ist in der Umwelt in verschiedenen Prozentsätzen vorhanden. Bei der Berechnung des Atomgewichts müssen wir sowohl die Isotopenmasse als auch ihre relativen Häufigkeiten berücksichtigen.

Abbildung 01: Standard -Atomgewicht von Kupfer
Darüber hinaus sind die Massen von Atomen extrem klein, daher können wir sie nicht in normalen Masseneinheiten wie Gramm oder Kilogramm ausdrücken. Die in der Perioden Tabelle angegebenen Gewichte werden wie oben berechnet und als relative Atommasse angegeben.
Die IUPAC -Definition für das Atomgewicht lautet jedoch wie folgt:
„Ein Atomgewicht (relative Atommasse) eines Elements aus einer bestimmten Quelle ist das Verhältnis der durchschnittlichen Masse pro Atom des Elements zu 1/12 der Masse eines Atoms von 12c.”
Die Masse des am häufigsten vorkommenden Isotops trägt mehr zum Atomgewicht bei. Zum Beispiel beträgt die natürliche Häufigkeit von Cl-35 75.76%, während die Häufigkeit von Cl-37 24 beträgt.24%. Das Atomgewicht von Chlor beträgt 35.453 (AMU), der näher an der Masse des CL-35-Isotops liegt.
Was ist Massenzahl?
Die Massenzahl ist die Gesamtzahl der Neutronen und Protonen im Kern eines Atoms. Wir nennen normalerweise die Sammlung von Neutronen und Protonen als Nukleonen. Daher können wir die Massenzahl auch als Anzahl der Nukleonen im Kern eines Atoms definieren.
Normalerweise bezeichnen wir diesen Wert in der linken oberen Ecke des Elements (als Superscript) als Ganzzahlwert. Unterschiedliche Isotope haben unterschiedliche Massenzahlen, da ihre Neutronen variieren. Somit gibt die Massenzahl eines Elements die Masse des Elements in Ganzzahlen an. Der Unterschied zwischen Massenzahl und Atomzahl eines Elements ergibt die Anzahl seiner Neutronen.
Was ist der Unterschied zwischen Atomgewicht und Massenzahl?
Der Hauptunterschied zwischen Atomgewicht und Massenzahl besteht darin. Meistens unterscheidet sich die Massenzahl erheblich vom Atomgewicht. Zum Beispiel hat Brom zwei Isotope. Die Massenzahl von einem Isotop beträgt 79, während die Massenzahl des anderen Isotops 81 beträgt. Darüber hinaus beträgt das Atomgewicht von Brom 79.904, was sich von beiden Isotopenmassen unterscheidet.
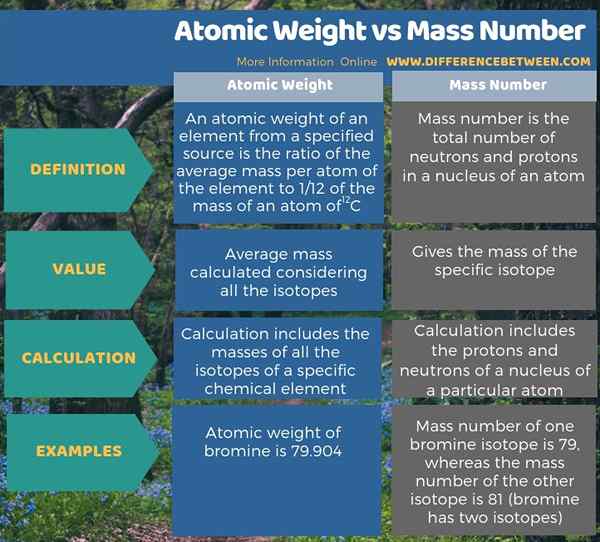
Zusammenfassung -Atomgewicht gegen Massenzahl
Atomgewicht und Massenzahl sind zwei verschiedene Konzepte in der Chemie. Der Hauptunterschied zwischen Atomgewicht und Massenzahl besteht darin.
Referenz:
1. Helmenstine, Anne Marie. „Atommassendefinition: Atomgewicht.”Thoughtco, Jan. 22, 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. „CIAAW 2013 - Standard Atomgewicht für Cupper (29, Cu)“ durch Depiep - eigene Arbeit (CC BY -SA 4.0) über Commons Wikimedia


