Unterschied zwischen zweizähnigen und ambindierten Liganden
Schlüsselunterschied - Bidentate vs Ambidentieren Liganden
Der Schlüsselunterschied Zwischen Bidentate und Ambidentat Liganden ist das Benzuckerate Liganden können über zwei Bindungen gleichzeitig an ein zentrales Atom binden, während ambidkte Liganden zwei Bindungen mit einem zentralen Atom bilden können, aber jeweils nur eine Bindung bilden können.
Liganden sind elektronenreiche Moleküle oder Anionen, die einsame Elektronenpaare an ein Atom spenden können. Es gibt verschiedene Arten von Liganden, die als Monodentate -Liganden, zweizähnige Liganden, Polydentatliganden usw. bezeichnet werden, usw. Basierend auf der Anzahl der Anleihen können sie mit einem Atom bilden.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind biddliche Liganden
3. Was sind ampidentierte Liganden
4. Ähnlichkeiten zwischen zweizähnigen und ambidierten Liganden
5. Seite an Seite Vergleich - Biddle vs Ambidentat Liganden in tabellarischer Form
6. Zusammenfassung
Was sind biddliche Liganden?
Benzuckerate Liganden sind Moleküle oder Anionen, die über zwei kovalente Bindungen an ein Atom binden können. Koordinate kovalente Bindungen sind eine Art kovalente Bindungen, die gebildet werden, wenn eine elektronenreiche chemische Spezies einsame Elektronenpaare an eine chemische Spezies mit elektronenmangelerem Spezies wie positiv geladene Metallatome spendet. Wenn Liganden und Kationen auf diese Weise binden, wird eine Koordinationsverbindung gebildet. Das Atom, an das die Liganden gebunden sind Koordinierungszentrum.
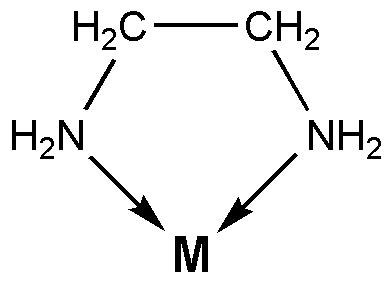
Abbildung 01: Ethylendiamin ist ein zweizähniger Ligand
Ein zweizähniger Ligand hat zwei Spenderatome. Dies bedeutet, dass es zwei Atome gibt, die ihre einsamen Elektronenpaare spenden können. Einige häufige Beispiele für die zweizähnigen Liganden sind Oxalation (C)2Ö42-) Das hat zwei Sauerstoffatome als Spenderatome und Ethylendiamin (C₂h₄ (NH₂) ₂ ₂ mit zwei Stickstoffatomen als Spenderatome.
Was sind ampidentierte Liganden?
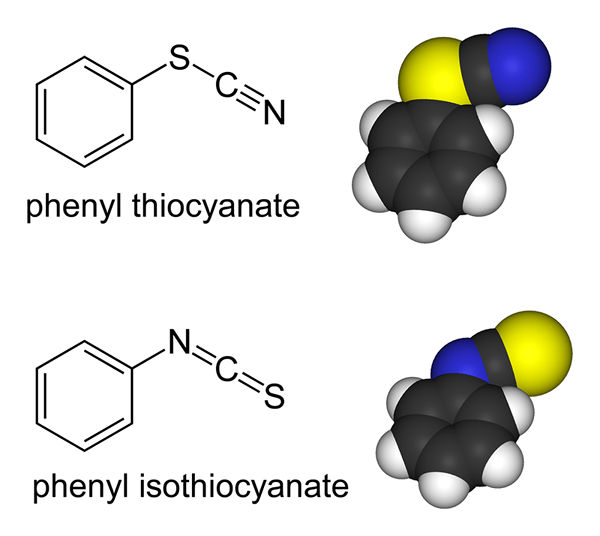
Ambidentate Liganden sind Moleküle oder Ionen mit zwei Spenderatomen, aber über ein Donoratom gleichzeitig mit einem Atom in der Lage sind, mit einem Atom zu binden. Beispiele für ambidentierte Liganden sind Thiocyanat -Ion (SCN-), in dem sowohl Schwefelatom als auch ein Stickstoffatom in der Lage sind, einsame Elektronenpaare zu spenden. Aber entweder das Schwefelatom oder das Stickstoffatom kann gleichzeitig an das Koordinationszentrum binden.

Abbildung 02: Thiocyanat ist ein ambidierter Ligand
Ein weiteres Beispiel ist Nitration (nein2-), in dem sowohl Stickstoffatom als auch Sauerstoffatom ein Spenderatom werden können.
Was sind die Ähnlichkeiten zwischen zweizähnigen und Ambidentaten Liganden?
- Sowohl zwei Bucker- als auch Ambidentat -Liganden haben zwei Spenderatome.
- Beide Liganden haben mindestens zwei Atome mit einzigen Elektronenpaaren.
Was ist der Unterschied zwischen zweizähnigen und ambidierten Liganden?
Biddle gegen Ambidentate Liganden | |
| Benzuckerate Liganden sind Moleküle oder Anionen, die über zwei kovalente Bindungen an ein Atom binden können. | Ambidentate Liganden sind Moleküle oder Ionen mit zwei Spenderatomen, aber über ein Donoratom gleichzeitig mit einem Atom in der Lage sind, mit einem Atom zu binden. |
| Bindungsbildung | |
| Benzuckeratische Liganden können jeweils zwei kovalente kovalente Bindungen bilden. | Ambidentate Liganden sind in der Lage, jeweils eine kovalente kovalente Bindung zu bilden. |
| Beispiele | |
| Beispiele für zweizähnige Liganden sind Ethylendiamin und Oxalation. | Beispiele für ambidentierte Liganden sind Thiocyanat -Ion- und Nitrationionen. |
Zusammenfassung - Biddle vs Ambidentieren Liganden
Liganden handelt. Backerate Liganden und Ambidentat -Liganden sind solche zwei Ligandenformen. Der Unterschied zwischen zweizähnigen und Ambidentat -Liganden besteht darin, dass zweizähnige Liganden über zwei Bindungen gleichzeitig mit einem zentralen Atom binden können.
Referenz:
1. "Liganden | Arten von Liganden | Chelate -Ligand, Dentizität, ambidkte Ligand | Chemie | Byju.Chemie, Byjus -Klassen, 8. März. 2018. Hier verfügbar
2. Libretexten. „Liganden.Chemie -Libretexte, Libretexten, 19. Januar. 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.'M-en1'By kein maschinelles Lesbarer Autor (öffentlich zugänglich) über Commons Wikimedia
2."PHSCN-PHNCS-Vergleiche" (Public Domain) über Commons Wikimedia


