Unterschied zwischen Bindung und Antibindungsmolekularorbitalen
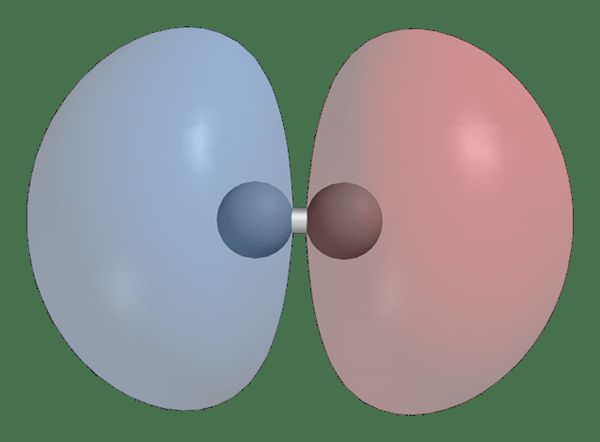
Bindung gegen Antibinding Molekularorbitale
Der Unterschied zwischen Bindung und Antibindungsmolekularorbitalen kann am besten mit der „molekularen Orbitalentheorie erklärt werden.”Diese beiden Arten von molekularen Orbitalen werden gebildet, wenn kovalente chemische Bindungen gebildet werden. Der signifikanteste Unterschied zwischen Bindung und Antibindungsmolekularorbitalen sind ihre Energieniveaus im Vergleich zu den Mutteratom -Orbitalen. Diese Energieniveau -Differenz führt zu anderen Unterschieden zwischen zwei molekularen Orbitalen.
Bindungs- und Antibindungsmolekülorbitale werden durch lineare kombinierte Atomorbitale gebildet. Die folgenden Schlüsselkonzepte sind sehr wichtig, um den Unterschied zwischen Bindung und Antibindungsmolekülorbitalen zu verstehen.
Aufbau -Prinzip - Orbitale mit der niedrigsten Energie werden zuerst gefüllt.
Pauli -Ausschlussprinzip - Die maximale Anzahl von Elektronen (mit gegenüberliegenden Spins), die ein Orbital besetzen können, beträgt zwei.
Hunds Regel - Wenn es mehrere molekulare Orbitale mit gleicher Energie gibt, belegen die Elektronen die molekularen Orbitale nacheinander, bevor zwei das gleiche molekulare Orbital einnehmen.
Was sind Bindungsmolekülorbitale?
Bindungsmolekulare Orbitale werden gebildet aus atomaren Orbitalen von In-Phase Kombination von atomaren Orbitalen. Es erhöht die Elektronendichte zwischen gebundenen Atomen. Ihre Energie ist niedriger als die Atomorbitale. Die Elektronen werden zuerst mit den molekularen Orbitalen der Bindung gefüllt und stabilisieren das Molekül, da sie im Elternatom weniger Energie als das Elektron assoziieren.
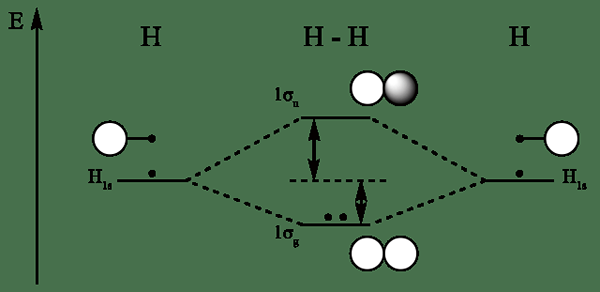
Molekulares Orbitaldiagramm für Wasserstoff
Was sind Antibinding molekulare Orbitale?
Antibinding molekulare Orbitale sind geformt von außerhalb der Phase Kombination von atomaren Orbitalen und es verringert die Elektronendichte zwischen zwei Atomen. In antibindenden molekularen Orbitalen ist die Energie höher als die atomaren Orbitale, die sie bildeten. Aufgrund dieser Tatsache destabilisiert sie die Bindung zwischen zwei Atomen.

H2 1Sσ* Antibonding Molekular Orbital
Was ist der Unterschied zwischen den molekularen Bindungsorbitalen und der Antibindungsmolekülorbitale?
• Energie:
ENERGIEAntibonding molekulare Orbitale > EnergieBindungsmolekülorbitale
• Die molekularen Bindungsorbitale haben eine geringere Energie im Vergleich zum Mutteratom -Orbital.
• Antibonding molekulare Orbitale besitzen eine hohe Energie als die von Eltern -Atom -Orbitalen.
• Im Allgemeinen werden Elektronen zuerst in niedrigere Energieniveaus gefüllt. Daher werden die Elektronen zuerst an molekulare Orbitale und dann an molekulare Orbitale gefüllt.
• Stabilität:
• Die molekularen Bindungsorbitale sind stabiler als sowohl Antibindungsmolekülorbitale als auch übergeordnetes Atom -Orbital.
• Antibonding molekulare Orbitale sind weniger stabil als sowohl die molekularen Orbitale als auch die Atom- oder Eltern -ORBTIALS.
• Der Hauptgrund für den Unterschied in der Stabilität ist der Energieniveau -Unterschied. Je höher die Energie ist, ist weniger Stabilität. Niedriger die Energie ist mehr ist die Stabilität.
• Elektronenverfügbarkeit:
• Die Wahrscheinlichkeit, ein Elektron zu finden.
• Es ist minimal.
• Beitrag für die Form des Moleküls:
• Molekülorbitale der Bindung tragen direkt zur Form des Moleküls bei.
• Antibindungsmolekularorbitale tragen nicht zur Form des Moleküls bei.
Bilder mit freundlicher Genehmigung:
- MO Diagramm Wasserstoff durch CCOIL (CC BY-SA 3.0)
- H2 1Sσ* Antibinding Molekular -Orbital über Wikicommons (öffentliches Domäne)


