Unterschied zwischen Borazin und Diborane
Der Schlüsselunterschied Zwischen Borazin und Diborane ist das Borazin enthält drei Boratome pro Molekül, während Diboran zwei Boratome pro Molekül enthält.
Borazin und Diboran sind borhaltige chemische Verbindungen. Beide sind zyklische Verbindungen mit unterschiedlichen Anzahl von Ringmitgliedern.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Borazin
3. Was ist Diborane
4. Seite an Seitenvergleich - Borazin gegen Diboran in tabellarischer Form
5. Zusammenfassung
Was ist Borazin?
Borazin ist eine zyklische anorganische Verbindung mit der chemischen Formel B3H6N3. Es ist eine zyklische Verbindung mit einer sechsgliedrigen Ringstruktur. Das heißt. Deshalb können wir seine chemische Formel als (BH "schreiben3) (NH3). Diese Struktur ist auch isoelektronisch mit dem Benzolring. Wie Benzol ist dies auch eine farblose Flüssigkeit bei Raumtemperatur. Deshalb nennen wir es manchmal "anorganische Benzol".
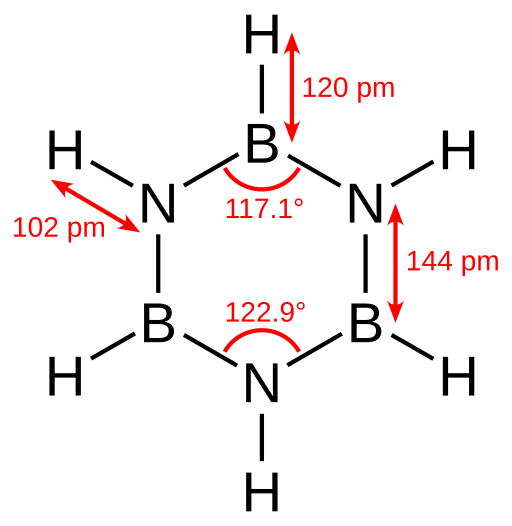
Abbildung 01: Struktur von Borazin
Darüber hinaus beträgt die Molmasse von Borazin 80.50 g/mol. Der Schmelzpunkt und die Siedepunkte betragen –58 ° C bzw. 53 ° C. Es hat auch einen aromatischen Geruch. Darüber hinaus ist dies eine synthetische Verbindung, die wir aus Diboran und Ammoniak im Verhältnis 1: 2 produzieren können.
Die an diesem Prozess verbundene chemische Reaktion ist wie folgt:
3 b2H6 + 6 NH3 → 2 b3H6N3 + 12 h2
Wenn wir vor allem Borazin in Wasser hinzufügen, wird es hydrolysiert, Borsäure, Ammoniak und Wasserstoffgas zu ergeben. Darüber hinaus ist diese Verbindung aufgrund ihrer Formationänderung der Enthalpie thermisch sehr stabil; –531 kJ/mol. Im Vergleich zu Benzol ist Borazin weitaus reaktiver. Zum Beispiel kann es mit Wasserstoffchlorid reagieren, während Benzol nicht kann.
Nach kristallographischen Röntgenbestimmungen sind die Bindungslängen in der Ringstruktur von Borazin gleich. Es kann jedoch kein perfektes Sechseck bilden, da das alternierende Muster von Stickstoff und Bor unterschiedliche Bindungswinkel und damit eine unterschiedliche molekulare Symmetrie ergibt.
Was ist Diborane?
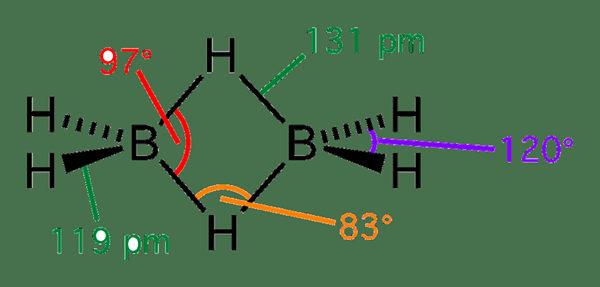
Diboran ist eine anorganische Verbindung mit der chemischen Formel B2H6. Diese Verbindung enthält Bor- und Wasserstoffatome in einer zyklischen Struktur. Es kommt als farbloses und pyrophorisches Gas vor. Es hat auch einen abstoßenden süßen Geruch. Die Molmasse von Diborane beträgt 27.67 g/mol.

Abbildung 02: Struktur von Diborane
Diboran wird als elektronenmangelhaftes Molekül betrachtet. Dies liegt daran. Darüber hinaus ist dies der Grund für die zyklische oder überbrückte Struktur des Diboranemoleküls.
Bei der Betrachtung der Eigenschaften von Diborane ist es ein farbloses und brennbares Gas bei Raumtemperatur. Es ist auch ein giftiges Gas. Wenn Diborane in Gegenwart von Sauerstoff in der Luft verbrannt ist, kann er eine hohe Energiemenge freisetzen. Wenn dieses Gas mit Wasser gemischt wird, hydrolysiert es schnell und ergibt Borsäure und Wasserstoffgas.
Was ist der Unterschied zwischen Borazin und Diborane?
Der Schlüsselunterschied zwischen Borazin und Diboran besteht darin. Ein weiterer Unterschied zwischen Borazin und Diboran besteht darin, dass Borazin eine farblose Flüssigkeit ist, während Diborane ein farbloses und brennbares Gas ist. Außerdem wird Borazin aus der Reaktion zwischen Diboran und Ammoniak gebildet, während Diboran aus der Reaktion zwischen Metallhydriden und Bor gebildet wird.
Unten finden Sie eine Tabelle des Unterschieds zwischen Borazin und Diboran.
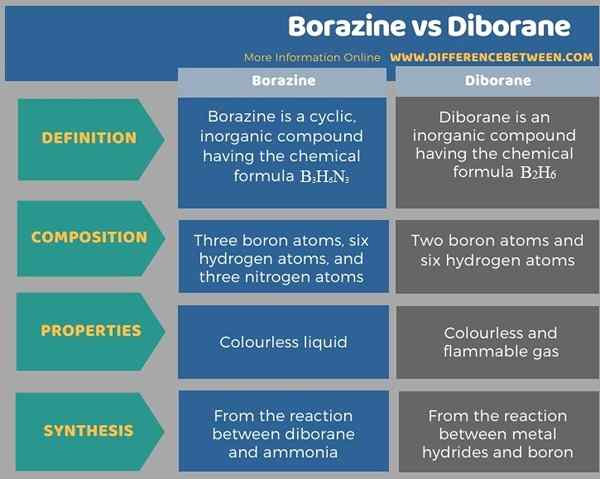
Zusammenfassung -Borazin gegen Diborane
Borazin und Diboran sind zyklische Strukturen. Der Schlüsselunterschied zwischen Borazin und Diboran besteht darin.
Referenz:
„Diborane - Struktur von Diborane, Vorbereitung, Eigenschaften, verwendet.Byjus, Byju, 16. Dezember. 2019, hier erhältlich.
„Diborane.”Wikipedia, Wikimedia Foundation, 6. Februar. 2020, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Borazin-Dimensions-2D" von HBF878-eigene Arbeit (CC0) über Commons Wikimedia
2. "Diborane-2d" (Public Domain) über Commons Wikimedia


