Unterschied zwischen Kohlenstoff 12 und Kohlenstoff 14
Der Schlüsselunterschied Zwischen Kohlenstoff 12 und Carbon 14 ist das Carbon 12 hat 6 Neutronen in seinem Atomkern, während Kohlenstoff 14 8 Neutronen aufweist.
Carbon 12 und Carbon 14 sind Isotope des Kohlenstoffatoms. Kohlenstoffatom hat immer 6 Protonen. Es hat normalerweise auch 6 Neutronen, weshalb wir es Carbon 12 nennen 12. Aber manchmal gibt es 8 Neutronen anstelle von 6, nämlich, wenn es Kohlenstoff 14 wird. Bei chemischen Reaktionen verhalten sich Carbon 12 und Carbon 14 auf ähnliche Weise. Im Allgemeinen ist Kohlenstoff in C 12 zu finden, ist aber gelegentlich auch als C 14 erhältlich.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Carbon 12
3. Was ist Carbon 14
4. Seite an Seite Vergleich - Kohlenstoff 12 gegenüber Kohlenstoff 14 in tabellarischer Form
5. Zusammenfassung
Was ist Carbon 12?
Carbon 12 ist das häufigste natürliche Kohlenstoffisotop von Masse 12. Es ist die Grundlage für die akzeptierte Skala der Atommasseneinheiten. Die Fülle dieses Kohlenstoffs beträgt rund 99%.

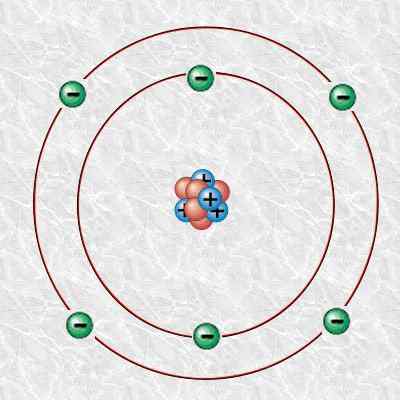
Abbildung 1: Kohlenstoffatom
Darüber hinaus besteht dieses Kohlenstoffatom aus 6 Protonen, 6 Elektronen und 6 Neutronen. Wir können den Kohlenstoff 12 wissenschaftlich als 12c bezeichnen. Seine Isotopenmasse beträgt 12 u.
Was ist Carbon 14?
Carbon 14 ist ein gemeinsames Isotop von Kohlenstoff. Wir nennen es „Radiokarbon“, da es sich um ein radioaktives Kohlenstoffisotop handelt. Der Atomkern dieses Atoms enthält 6 Protonen, 6 Elektronen und 8 Neutronen. Seine Isotopenmasse beträgt 14 u. Darüber hinaus ist Carbon 14 sehr selten und seine Fülle beträgt etwa 1 Teil pro Billion.
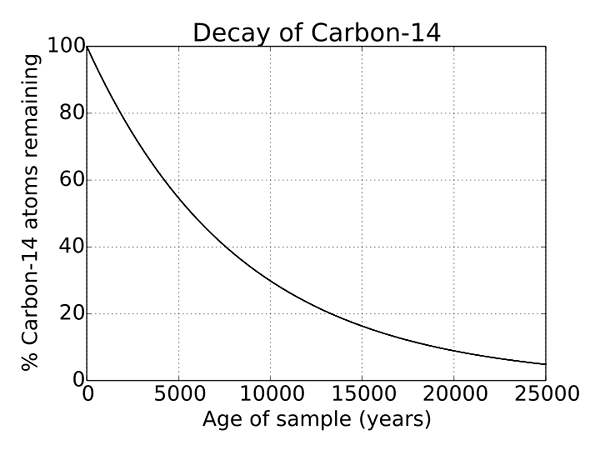
Abbildung 2: radioaktiver Zerfall von Kohlenstoff 14
Da C 14 ein instabiles Isotop des Kohlenstoffatoms ist, wird es radioaktives Verfall unterzogen. Und dies ist ein Prozess, der für jedes instabile Isotop auftritt und ein natürlicher Prozess ist. Es ist eine einzigartige Eigenschaft von C 14 und wird zur Bestimmung von Objekten verwendet, die Tausende von Jahren alt sind und in der Archäologie ausgiebig verwendet werden. Die Halbwertszeit von C 14 beträgt 5730 Jahre.
Was ist der Unterschied zwischen Kohlenstoff 12 und Kohlenstoff 14?
C 12 und C 14 sind Isotope des Kohlenstoffatoms. Der Schlüsselunterschied zwischen Kohlenstoff 12 und Carbon 14 besteht darin, dass Carbon 12 6 Neutronen in seinem Atomkern aufweist, während Kohlenstoff 14 8 Neutronen aufweist. Da das Gewicht von Protonen und Neutronen gleich ist und 8 Neutronen mit 20% schwerer als C 12 ist, ist C 14 20%. Da sowohl C 12 als auch C 14 die gleiche Anzahl von Protonen haben, ist ihre Atomzahl gleich, aber ihre Atomgewichte sind aufgrund der unterschiedlichen Anzahl von Neutronen unterschiedlich. Dies ist also ein signifikanter Unterschied zwischen C 12 und C 14.
Darüber hinaus verhalten sich C 12 und C 14 auch anders, wenn es um Kernreaktionen geht. Ein weiterer Unterschied zwischen C 12 und C 14 besteht darin, dass C 12 in der Erdkruste reichlich vorhanden ist, während C 14 selten ist. Außerdem ist C 12 ein stabiles Isotop von Kohlenstoff, während C 14 ein instabiles Isotop des Kohlenstoffatoms ist und radioaktives Verfall durchläuft.

Zusammenfassung -Kohlenstoff 12 gegen Kohlenstoff 14
Carbon 12 und Carbon 14 sind Isotope des Kohlenstoffatoms. Kohlenstoffatom hat immer 6 Protonen, aber die Anzahl der Neutronen kann variieren. Zum Beispiel sind Kohlenstoff 12 und Carbon 14 unterschiedliche Isotope Kohlenstoff mit unterschiedlichen Anzahl von Neutronen. Daher besteht der Schlüsselunterschied zwischen Carbon 12 und Carbon 14 darin, dass Carbon 12 in seinem Atomkern 6 Neutronen aufweist, während Kohlenstoff 14 8 Neutronen aufweist.
Referenz:
1. "Kohlenstoff.”Encyclopædia Britannica, Encyclopædia Britannica, Inc., 7. Februar. 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Carbon-Atom" von Alejandro Porto-eigene Arbeit (CC BY-SA 3.0) über Commons Wikimedia
2. "Radioaktives Zerfall von Carbon-14 SVG" von Exeterpaul-eigene Arbeit (CC BY-SA 3.0) über Commons Wikimedia


