Unterschied zwischen Carbonat und Bicarbonat
Der Schlüsselunterschied Zwischen Carbonat und Bicarbonat ist das Das Carbonation hat -2 elektrische Ladung, während das Bicarbonat -1 elektrische Ladung hat.
Der menschliche Körper produziert Kohlendioxid als Nebenprodukt des Stoffwechsels. Der größte Teil dieses Kohlendioxids löst sich im Blutplasma und in Form von Bicarbonat vor. Das Carbonat- und Bicarbonat -System ist hauptsächlich für die Aufrechterhaltung unseres Blut -pH -Werts verantwortlich und wirkt als Puffer in unserem Blut. Wenn sich Kohlendioxid in Wasser, Bicarbonat und Kohlensäure auflöst, Formen, und es gibt ein Gleichgewicht zwischen diesen Spezies.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Carbonat
3. Was ist Bicarbonat
4. Seite an Seitenvergleich - Carbonat gegen Bicarbonat in tabellarischer Form
5. Zusammenfassung
Was ist Carbonat?
Carbonat ist ein anorganisches Ion, das ein Kohlenstoffatom und drei Sauerstoffatome enthält. Es hat eine negative Trennladung (-2 elektrische Ladung). Carbonation hat eine trigonale planare Geometrie, und sein Molekulargewicht beträgt 60 g mol-1.
Obwohl die Lewis-Struktur von Carbonation eine Kohlenstoffoxygen-Doppelbindung und zwei Einzelbindungen mit Kohlenstoffoxygen aufweist, ist es nicht die tatsächliche Struktur. Carbonation zeigt eine Resonanzstabilisierung. Daher hat es eine hybride Struktur aller Resonanzstrukturen. Daher haben alle Kohlenstoffoxygenbindungen eine ähnliche Länge, und die Sauerstoffatome haben eine teilweise negative Ladung (daher sind alle Sauerstoffatome ähnlich.).
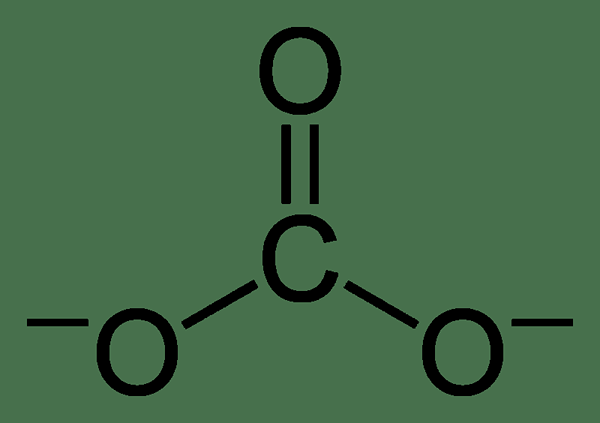
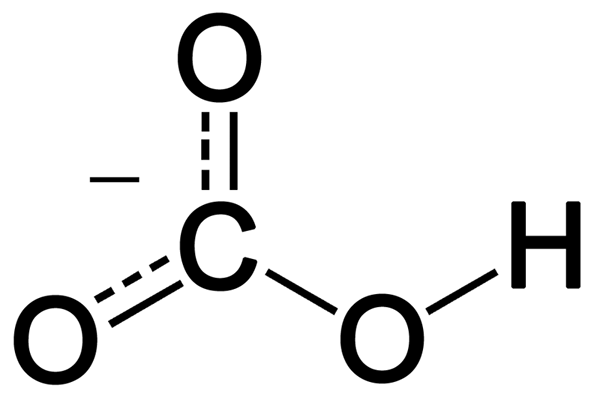
Abbildung 01: Chemische Struktur von Carbonation
Wenn Kohlendioxid oder Bicarbonat in Wasser auflöst, bilden sich Carbonationen. Und dieses Ion ist im Gleichgewicht mit Bicarbonationen. Natürlich kombiniert es sich mit einem anderen Metallion oder einem anderen positiven Ion, um Verbindungen herzustellen. Es gibt verschiedene Arten von Carbonatgesteinen wie Kalkstein (Calciumcarbonat), Dolomit (Calcium-Magnesiumcarbonat), Kalischiff (Kaliumcarbonat) usw.
Darüber hinaus spielen Carbonatverbindungen eine entscheidende Rolle im Kohlenstoffzyklus. Mit der Zeit verwandelt sich die Verbindungen, die Kohlenstoff enthalten. Wenn diese Gesteine verwittert, wird Kohlendioxid wieder in die Atmosphäre freigesetzt. Ebenso füllen sie beim Erhitzen dieser Verbindungen Kohlendioxid leicht frei. Darüber hinaus sind Carbonatverbindungen ionisch und in Wasser unlöslich.
Was ist Bicarbonat?
Bicarbonat ist ein einwertiges Anion mit einem Wasserstoff, einem Kohlenstoff und drei Sauerstoffatomen. Es bildet sich aus der Deprotonation von Kohlensäure. Es hat eine trigonale planare Geometrie um das zentrale Kohlenstoffatom. Bicarbonation hat ein Molekulargewicht von 61 g mol-1.

Abbildung 02: Resonanzstruktur von Bicarbonation
Darüber hinaus zeigt dieses Ion eine Resonanzstabilisierung zwischen den beiden Sauerstoffatomen, die nicht mit Wasserstoff verbunden sind. In der Natur ist Bicarbonat alkalisch und die Konjugatsäure des Carbonation und die konjugierte Base der Kohlensäure. Darüber hinaus können sich die positiv geladenen Ionen mit dem negativ geladenen Sauerstoff in diesem Ion kombinieren und ionische Salze bilden. Das häufigste Salz von Bicarbonat ist Natriumbicarbonat, das wir im täglichen Gebrauch als Backpulver nennen. Darüber hinaus füllen Bicarbonatverbindungen Kohlendioxid bei der Reaktion mit Säuren frei.
Was ist der Unterschied zwischen Carbonat und Bicarbonat?
Carbonat und Bicarbonat sind anorganische Anionen. Der Hauptunterschied zwischen Carbonat und Bicarbonat besteht darin, dass das Carbonation -2 -elektrische Ladung aufweist, während das Bicarbonat -1 elektrische Ladung hat. Darüber hinaus beträgt die Molmasse von Carbonation aufgrund des Vorhandenseins des Wasserstoffatoms 60 g/mol, während die Molmasse von Bicarbonation 61 g/mol beträgt.
Ein weiterer signifikanter Unterschied zwischen Carbonat und Bicarbonat besteht darin, dass es bei stark grundlegenden Bedingungen mehr Carbonationen geben wird, während Bicarbonat -Ionen in schwache Basislösungen stärker sein werden. Darüber hinaus trägt die Fähigkeit, sich in Wasser aufzulösen, zu einem Unterschied zwischen Carbonat und Bicarbonat bei. Das ist; Die Verbindungen mit Carbonationen sind bei Raumtemperatur und atmosphärischem Druck in Wasser nicht löslich. Viele Bicarbonat -Salze sind jedoch bei Raumtemperatur in Wasser löslich.
Nachfolgend finden Sie eine Zusammenfassung des Unterschieds zwischen Carbonat und Bicarbonat in tabellarischer Form.
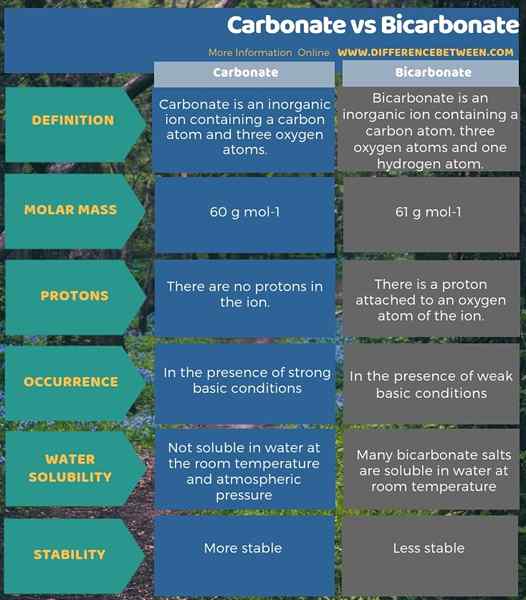
Zusammenfassung -Carbonat gegen Bicarbonat
Sowohl Carbonat als auch Bicarbonat sind Ionen, die Kohlenstoff- und Sauerstoffatome enthalten. Bicarbonation hat jedoch auch ein Wasserstoffatom. Daher führt dieses Wasserstoffatom dazu. Zusammenfassend lässt sich sagen.
Referenz:
1. Britannica, die Herausgeber von Encyclopaedia. "Karbonat.”Encyclopædia Britannica, Encyclopædia Britannica, Inc., 20. Juli 1998. Hier verfügbar
2. „Bicarbonat -Ion.Nationales Zentrum für Biotechnologieinformationen. Pubchem Compound -Datenbank, u.S. Nationalbibliothek für Medizin. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.”Carbonat-Ionen-localised-2d” von Ben Mills-eigene Arbeit, (Public Domain) über Commons Wikimedia
2."Bicarbonat-Resonanz" von Hellbus-eigener Arbeit, (CC BY-SA 3.0) über Commons Wikimedia


