Unterschied zwischen Chlorit und Chlorid
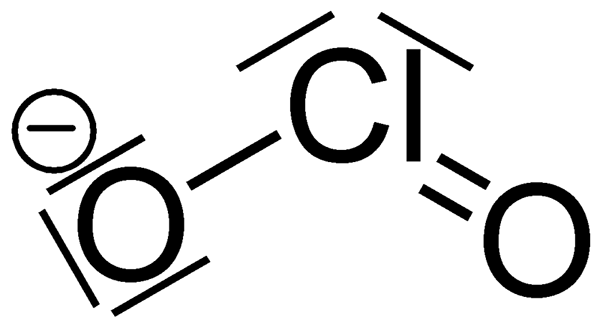
Der Schlüsselunterschied zwischen Chlorit und Chlorid ist, dass Chlorition ein stark oxidierendes Mittel ist, während Chlorid kein Oxidationsmittel ist.
Chlorit und Chlorid sind Anionen, die aus Chloratomen stammen. Diese Anionen können ihre Oxidationszustände während einer chemischen Reaktion erhöhen, aber nur Chloritionen kann seinen Oxidationszustand weiter verringern, während Chloridion nicht kann. Daher ist Chlorit ein Oxidationsmittel, aber Chloridion nicht.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Chlorit
3. Was ist Chlorid
4. Seite an Seitenvergleich -Chlorit gegen Chlorid in tabellarischer Form
5. Zusammenfassung
Was ist Chlorit?
Chlorit ist ein Anion mit der chemischen Formel CLO2-. Die Molmasse dieses Anion beträgt 67.45 g/mol. Es ist auch als Chlordioxidanion bekannt, und es ist ein Beispiel für Halit. Chloritverbindungen sind chemische Verbindungen, die dieses Anion enthalten; Chlor befindet sich im +3 Oxidationszustand. Chlorite sind die Salze von Chlorsäure.
Bei der Betrachtung der Chemie von Chloritionen hat es eine gebogene molekulare Geometrie aufgrund der Wirkung der einsamen Elektronenpaare auf Chloratome. Der Bindungswinkel der O-Cl-O-Bindung beträgt etwa 111 Grad. Darüber hinaus ist Chlorit das stärkste Oxidationsmittel unter anderen Chlor -Oxyanionen, abhängig vom halben Zellpotential.
Die häufigste Anwendung von Chlorit ist sein Natriumsalz (Natriumchlorit), das für das Bleichen von Textile, Zellstoff und Papier aufgrund ihrer stark oxidierenden Natur nützlich ist. Es wird jedoch nicht direkt verwendet, und stattdessen müssen wir die neutralen Chlordioxidspezies über die Reaktion mit HCL erzeugen.
Was ist Chlorid?
Chlorid ist das Anion mit der chemischen Formel CL-. Dieses Anion stammt aus einem Chloratom. Typischerweise besteht ein Chloratom aus 17 Elektronen und weist aufgrund der unvollständigen Orbitalfüllung eine instabile Elektronenkonfiguration auf. Daher sind Chloratome sehr reaktiv und bilden Chloridionen, indem sie ein Elektron von außen erhalten. Dieses eingehende Elektron nimmt das äußerste Orbital des Chloratoms ein. Es gibt jedoch nicht genug positive Ladungen im Chlorkern, um die negative Ladung dieses Elektrons zu neutralisieren. Daher bildet es ein Anion namens Chloridion. Ein häufiges Beispiel für eine Verbindung, die ein Chloridion enthält, ist Tischsalz oder Natriumchlorid.
Das Chloridion hat 18 Elektronen. Die Elektronenkonfiguration ähnelt der eines Argonatoms. Es ist weniger reaktiv und seine Elektronegativität ist ebenfalls sehr weniger. Es neigt dazu, ein anderes eingehendes Elektron aufgrund seiner negativen Ladung abzuwehren.
Verbindungen, die Chloridionen enthalten. Die meisten dieser Chloride sind wasserlöslich. Wenn diese Verbindungen in Wasser gelöst sind, sind das Anion und das Kation voneinander getrennt. Da es sich bei diesen Ionen um elektrisch geladene Ionen handelt, kann eine Lösung, die aus Chloridionen und jedem anderen Kation besteht.
Unterschied zwischen Chlorit und Chlorid
Chlorit und Chlorid sind Anionen, die aus Chloratomen stammen. Chlorit ist ein Anion mit der chemischen Formel CLO2- Während Chlorid das Anion mit der chemischen Formel CL ist-. Chlorit ist ein Oxyanion und enthält Sauerstoffatome außerhalb von Chlor. Der Hauptunterschied zwischen Chlorit und Chlorid besteht darin, dass Chloritionen ein stark oxidierendes Mittel ist.
Nachfolgend finden Sie eine Zusammenfassung des Unterschieds zwischen Chlorit und Chlorid in tabellarischer Form.
Zusammenfassung -Chlorit gegen Chlorid
Chlorit und Chlorid sind Anionen, die aus Chloratomen stammen. Der Hauptunterschied zwischen Chlorit und Chlorid besteht darin, dass Chloritionen ein stark oxidierendes Mittel ist.
Referenz:
1. „Halogene als Oxidationsmittel.” Chemie -Libretexten, Libretexten.
Bild mit freundlicher Genehmigung:
1. "Chlorition" von Eschenmoser - eigene Arbeiten mit: Chemdraw 8.0 (Public Domain) über Commons Wikimedia


