Unterschied zwischen Chloroform und Kohlenstofftetrachlorid
Der Schlüsselunterschied Zwischen Chloroform und Kohlenstofftetrachlorid ist das das Chloroform (CHCL3) ist ein starkes Anästhetikum, aber Kohlenstofftetrachlorid (CCL4) ist keine Anästhetikum.
Darüber hinaus hat sowohl Chloroform als auch Kohlenstofftetrachlorid die gleiche chemische Geometrie; Tetraedrische Geometrie. Da die chemische Struktur und Zusammensetzung von Kohlenstofftetrachlorid Chloroform ähnelt, verstehen die meisten Menschen den Gedanken, dass beide gleich sind. Kohlenstofftetrachlorid hat jedoch nur Kohlenstoff- und Chloratome, während Chloroform Kohlenstoff-, Chlor- und Wasserstoffatome aufweist.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Chloroform
3. Was ist Kohlenstofftetrachlorid
4. Seite an Seitenvergleich - Chloroform gegen Kohlenstofftetrachlorid in tabellarischer Form
5. Zusammenfassung
Was ist Chloroform?
Chloroform ist CHCL3 , die als starkes Anästhetikum verwendet wird. Der IUPAC -Name dieser Verbindung ist Trichlormethan. Es ist eine farblose und dichte Flüssigkeit, die einen süßen Geruch hat. Der Zweck der groß angelegten Produktion dieser Verbindung ist als Vorläufer für die Herstellung von PTFE. Der größte Teil des Chloroforms in der Umwelt (etwa 90%) ist auf Emissionen natürlicher Herkunft zurückzuführen. EX: Viele Arten von Algen und Pilzen produzieren diese Verbindung.
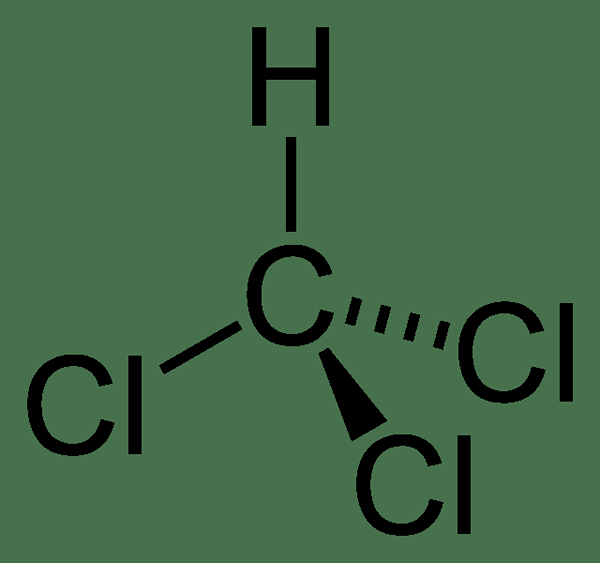
Die Molmasse der Verbindung ist 119.37 g/mol, und es erscheint bei Raumtemperatur als farblose Flüssigkeit. Es hat einen schweren ätherischen Geruch. Der Schmelzpunkt ist –63.5 ° C und der Siedepunkt ist 61.15 ° C. Darüber hinaus zersetzt es sich bei 450 ° C. Das Chloroformmolekül hat eine tetraedrische Geometrie.

Abbildung 01: Chemische Struktur von Chloroform
Im industriellen Maßstab können wir diese Verbindung durch Erhitzen einer Mischung aus Chlor und Chlormethan produzieren (oder manchmal verwenden wir auch Methan). Nach dem Erhitzen tritt bei 400-500 ° C eine free radikale Halogenierung auf. Dort bilden die chlorierten Verbindungen von Chlormethan (oder Methan), die Chloroform ergeben. Dort kann diese Verbindung eine weitere Chlorierung erfahren und Kohlenstofftetrachlorid bilden. Das Endprodukt dieser Reaktion ist jedoch eine Mischung aus Chlormethanen, die wir durch Destillation trennen können, um Chloroform zu erhalten.
Es gibt viele Anwendungen von Chloroform. Es ist als Lösungsmittel nützlich, da Wasserstoffatom in diesem Molekül eine Wasserstoffbrückenbindung erfahren kann. Wir können es auch als Reagenz für viele chemische Reaktionen verwenden. Beispiel: Als Quelle der Dichlorocarbän -Gruppe. Noch wichtiger ist, dass Chloroform für seine Anästhesiemeigenschaften bekannt ist.
Was ist Kohlenstofftetrachlorid?
Kohlenstofftetrachlorid ist CCL4 , was wir üblicherweise "Tetrachlormethan" bezeichnen. Es ist eine farblose Flüssigkeit mit süßem Geruch. Wir können es auch bei niedrigen Werten aus seinem Geruch erkennen. In der Reinigungsindustrie ist der gebräuchliche Name dieser Verbindung Kohlenstofftet.
Die Molmasse beträgt 153.81 g/mol. Der Schmelzpunkt ist –22.92 ° C, und der Siedepunkt ist 76.72 ° C. Die Geometrie dieses Moleküls ist die tetraedrische Geometrie. Da es vier Chloratome hat, die an ein einzelnes Kohlenstoffatom gebunden sind, sind die Bindungswinkel der Moleküle gleich. Wir nennen es eine „symmetrische Geometrie“. Aufgrund dieser Geometrie ist die Verbindung nichtpolar. Es ähnelt der Struktur des Methanmolekül.
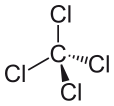
Abbildung 02: Chemische Struktur von Kohlenstofftetrachlorid
Es gibt viele Anwendungen von Kohlenstofftetrachlorid. Vor dem Verbot wurde diese Verbindung verwendet, um CFC in großem Maßstab zu produzieren. Heutzutage produzieren wir keine FAC, da es die Ozonschicht schädelt. Carbon -Tetrachlorid ist die wichtigste Zutat in Lava -Lampen. Sobald es ein beliebtes Lösungsmittel war, verwenden wir es aber aufgrund seiner negativen gesundheitlichen Auswirkungen nicht. Darüber hinaus verwenden wir es in Feuerlöschern, als Vorläufer von Kältemitteln und als Reinigungsmittel.
Was ist der Unterschied zwischen Chloroform und Kohlenstofftetrachlorid?
Chloroform ist CHCL3 und ist nützlich als starkes Anästhetikum. Kohlenstofftetrachlorid ist CCL4, Was wir üblicherweise "Tetrachlormethan" bezeichnen, ist kein Anästhetikum. Dies ist der Schlüsselunterschied zwischen Chloroform und Kohlenstofftetrachlorid. Darüber hinaus hat Chloroform nach der molekularen Struktur fünf Atome; Ein Kohlenstoffatom, ein Wasserstoffatom und drei Chloratome, und die molekulare Geometrie ist die tetraedrische asymmetrische Geometrie. Obwohl auch das Kohlenstoff -Tetrachlorid fünf Atome hat, hat es ein Kohlenstoffatome und vier Chloratome, und die molekulare Geometrie ist die symmetrische tetraedrische Geometrie. In Anbetracht ihrer Eigenschaften beträgt die Molmasse von Chloroform 119.37 g/mol. Es erscheint als dichte farblose Flüssigkeit und hat einen schweren ätherischen Geruch. Während die Molmasse von Kohlenstofftetrachlorid 153 beträgt.81 g/mol. Es erscheint als farblose Flüssigkeit und hat einen süßen Geruch. Die folgende Infografik enthält mehr Details zum Unterschied zwischen Chloroform und Kohlenstofftetrachlor in tabellarischer Form.
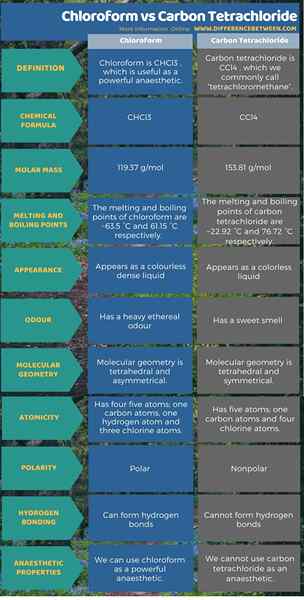
Zusammenfassung -Chloroform gegen Kohlenstofftetrachlorid
Da sowohl Chloroform- als auch Kohlenstoff -Tetrachlorid in ihrer chemischen Struktur und Zusammensetzung ähneln, verstehen die meisten Menschen sie als dieselbe Verbindung missverstehen. Kohlenstofftetrachlorid hat jedoch nur Kohlenstoff- und Chloratome, während Chloroform Kohlenstoff-, Chlor- und Wasserstoffatome aufweist. Darüber hinaus besteht der Schlüsselunterschied zwischen Chloroform und Kohlenstofftetrachlorid darin, dass wir Chloroform als starkes Anästhesie verwenden können, aber wir können kein Kohlenstoff -Tetrachlorid als Anästhesie verwenden.
Referenz:
1. "Chloroform.Nationales Zentrum für Biotechnologieinformationen. Pubchem Compound -Datenbank, u.S. Nationalbibliothek für Medizin. Hier verfügbar
2. "Tetrachlorkohlenstoff.Nationales Zentrum für Biotechnologieinformationen. Pubchem Compound -Datenbank, u.S. Nationalbibliothek für Medizin. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.”Chloroform" von Benjah-BMM27 ", vektorisiert von Fvasconcellos (Public Domain) über Commons Wikimedia
2.”Tetrachlormethan” von Neurotiker (Diskus


