Unterschied zwischen Kombination und Zersetzungsreaktion

Schlüsselunterschied - Kombination gegen Zerlegungsreaktion
Eine chemische Reaktion ist die Umwandlung einer oder mehrerer chemischer Verbindungen in ein oder mehrere verschiedene Produkte, wodurch die Identität einer chemischen Verbindung verändert wird. Das Ausgangsmaterial einer chemischen Reaktion wird als Reaktant bezeichnet und die resultierende Verbindung wird als Produkt bezeichnet. Der Abbau von Verbindungen oder Kombination von Verbindungen und Bildung neuer Verbindungen treten während eines chemischen Reaktionsprozesses auf, da die Bindungen zwischen den Atomen der Verbindung auf unterschiedliche Weise gebrochen und erzeugt werden. Chemische Reaktionen können in mehrere breite Kategorien unterteilt werden. Redoxreaktionen oder Oxidationsreduzierungsreaktionen sind bei ihnen sehr wichtig. Die Oxidations- und Reduktionsreaktionen werden als Elektronentransferreaktionen bezeichnet, da die Elektronen der Reaktanten von einer Verbindung zur anderen übertragen werden, um die Reaktion zu verursachen. Bei Redoxreaktionen treten gleichzeitig zwei parallele Reaktionen auf, die als Halbreaktionen bezeichnet werden. Diese Halbreaktionen zeigen die Übertragung von Elektronen. Indem man diese Halbreaktionen ausgleichen, kann man die allgemeine Reaktion erraten, die am Ende stattgefunden hat. Kombinationsreaktionen und Zersetzungsreaktionen sind zwei Haupttypen von Redoxreaktionen. Der Hauptunterschied zwischen Kombination und Zersetzungsreaktion ist das Die Kombinationsreaktion beinhaltet eine Kombination von Reaktanten, um ein einzelnes Produkt zu ergeben wohingegen Die Zersetzungsreaktion beinhaltet den Aufbau einer einzelnen Verbindung in zwei oder mehr Produkte.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist eine Kombinationsreaktion
3. Was ist eine Zersetzungsreaktion
4. Seite an Seitenvergleich - Kombination gegen Zerlegungsreaktion
5. Zusammenfassung
Was ist eine Kombinationsreaktion?
Eine Kombinationsreaktion, auch als als als genannt Synthesereaktion, ist eine Reaktion, bei der Reaktantenverbindungen zu einer anderen Verbindung als Produkt kombiniert werden. Mit anderen Worten, die Reaktion einfacher Moleküle führt zu einem komplexen Molekül. Einige oder alle Bindungen zwischen den Atomen dieser bestimmten Verbindung werden abgebaut; Gleichzeitig werden Atome zu der neuen Verbindung kombiniert, die das Produkt ist. Bei den Zersetzungsreaktionen wirkt derselbe Reaktanten wie das Ausgangsmaterial für beide Halbreaktionen. Im Gegensatz zu Zersetzungsreaktionen haben die Halbreaktionen in Kombinationsreaktionen zunächst unterschiedliche Reaktanten. Die Kombinationsreaktion führt zu einem einzelnen Produkt. Im Folgenden finden Sie ein häufiges Beispiel, das als Verbrennungsreaktionen angegeben werden kann.
Zum Beispiel, wenn Aluminium (AL) in flüssiges Bromid (BR) platziert wird2) Eine Kombinationsreaktion tritt auf und erzeugt Aluminiumbromid (ALBR3). Hier wird die Oxidationszahl in AL erhöht und in BR verringert. Daher handelt es sich um eine Redoxreaktion und eine Kombinationsreaktion, da zwei Reaktanten auf ein bestimmtes Produkt reagiert haben.
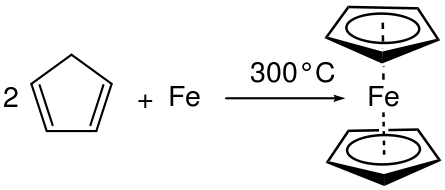
Abbildung 01: Kombinationsreaktion
Was ist Zerlegungsreaktion?
Die Zersetzungsreaktion ist eine weitere wichtige Reaktion in der Kategorie der Redoxreaktionen. Es ist im Grunde das Gegenteil der Kombinationsreaktion. Eine Zersetzungsreaktion ist eine Reaktion, bei der die Reaktantenverbindung in Produkte unterteilt wird. Hier treten Halbreaktionen gleichzeitig mit der Oxidationsreaktion und der Reduktionsreaktion auf. Im Gegensatz zu Kombinationsreaktion ist der Reaktant für beide Halbreaktionen bei Zerlegungsreaktionen gleich. Die Zerlegung der Zersetzung führt zu mehreren Produkten.
Bei der Elektrolyse von Wasser werden Wassermoleküle zersetzt, wenn der Gleichstrom durch Wasser geleitet wird, um Sauerstoff- und Wasserstoffgase zu ergeben. Hier ist die Oxidationszahl im Sauerstoffatom erhöht und im Wasserstoffatom verringert. Daher handelt es sich.

Abbildung 02: Kombination gegen Zersetzung
Was ist der Unterschied zwischen Kombination und Zersetzungsreaktion?
Kombination gegen Zerlegungsreaktion | |
| Zwei oder mehr Reaktantenverbindungen sind an Kombinationsreaktionen beteiligt. | Eine einzelne Verbindung ist an einer Zersetzungsreaktion beteiligt. |
| Produkte | |
| Die Kombinationsreaktion führt zu einem einzelnen Produkt. | Zersetzungsreaktionen führen zu mehreren Produkten. |
| Halbreaktionen | |
| In Kombinationsreaktionen haben zwei Halbreaktionen zwei verschiedene Startmoleküle. | Bei Zersetzungsreaktionen wirkt ein einzelnes Molekül als Ausgangsmaterial für beide Halbreaktionen. |
| Chemische Bindungen | |
| Kombinationsreaktionen führen dazu, dass Atome das einzelne Endprodukt erzeugen. | Bei Zersetzungsreaktionen werden chemische Bindungen zu zwei oder mehr Endprodukten zerlegt. |
| Moleküle | |
| Kombinationsreaktionen führen zu einfachen Molekülen, um komplexe Moleküle zu reagieren und zu produzieren. | Zersetzungsreaktionen führen dazu, dass komplexe Moleküle in einfache Moleküle zerlegt werden. |
Zusammenfassung -Kombination gegen Zerlegungsreaktion
Redoxreaktionen sind ein Teil der Welt um uns herum, da die Mehrheit der wichtigen chemischen Reaktionen Redoxreaktionen sind. Kombinationsreaktionen und Zersetzungsreaktionen sind einfache Reaktionen, die voneinander entgegengesetzt sind. Der Hauptunterschied zwischen Kombination und Zersetzungsreaktion besteht darin, dass die Kombinationsreaktion die Kombination von zwei oder mehr Reaktantenmolekülen beinhaltet, um zu einem einzelnen Endprodukt zu führen, während die Zersetzungsreaktion den Aufbau eines einzelnen Moleküls in zwei oder mehr Produkte beinhaltet.
Verweise:
1.Chang, r., 2010. Chemie. 10. Aufl. Newyork: McGraw-Hill.
2.Redox. (2009, 30. Juli). Abgerufen am 29. Mai 2017 von https: // weapintinctions.WordPress.com/primer/redox/
3.Reaktionen. (N.D.). Abgerufen am 29. Mai 2017 von http: // www.Ric.edu/fakultät/ptiskus/reaktionen/
Bild mit freundlicher Genehmigung:
1. "Miller Ferrocen Synthese" von Bert.Kilanowski - eigene Arbeit (CC0) über Commons Wikimedia
2. "Chemische Reaktionen" von Daniele Pugliesi - eigene Arbeit (CC BY -SA 3.0) über Commons Wikimedia [Cropped]


