Unterschied zwischen Delokalisierung und Resonanz
Der Schlüsselunterschied Zwischen Delokalisierung und Resonanz ist das Die Delokalisierung bezieht sich auf Elektronen, die über den gesamten Bereich eines Moleküls verteilt sind, anstatt an ein einzelnes Molekül gebunden zu sein, während sich eine Resonanz auf die Stabilisierung eines Moleküls aufgrund der Delokalisierung von Elektronen bezieht.
Delokalisierung und Resonanz sind verwandte chemische Konzepte. Der Resonanzeffekt wird unter Verwendung der Elektronendelokalisierung chemischer Verbindungen erklärt.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Delokalisierung
3. Was ist Resonanz
4. Seite für Seitenvergleich - Delokalisierung vs Resonanz in tabellarischer Form
5. Zusammenfassung
Was ist Delokalisierung?
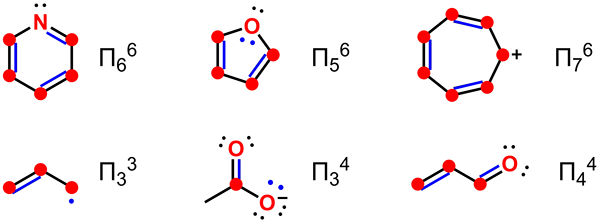
Die Delokalisierung ist ein Begriff, der sich auf die Verteilung von nicht gebundenen PI -Elektronen durch ein Molekül bezieht. Daher können wir delokalisierte Elektronen als nicht gebundene Elektronen in dieser chemischen Verbindung beschreiben. Der Begriff Delokalisierung bezieht sich auf Elektronen, die nicht mit einem einzelnen Atom oder einer kovalenten Bindung verbunden sind. Dennoch hat der Begriff delokalisiertes Elektron in verschiedenen Bereichen unterschiedliche Bedeutungen. Zum Beispiel sind in der organischen Chemie delokalisierte Elektronen in den Resonanzstrukturen konjugierter Systeme in aromatischen Verbindungen enthalten. In ähnlicher Weise sind delokalisierte Elektronen in der Festkörperphysik die freien Elektronen, die die elektrische Leitung erleichtern. Darüber hinaus verwenden die Quantenphysik den Begriff delokalisierte Elektronen, um sich auf molekulare Orbitalelektronen zu beziehen, die sich über mehrere Atome verlängert haben.

Abbildung 01: Elektronendelokalisierung in Molekülen
Das einfachste Beispiel, das wir für ein aromatisches System mit delokalisierten Elektronen geben können, ist der Benzolring. Der Benzolring hat sechs PI -Elektronen im Benzolmolekül; Wir geben diese häufig mit einem Kreis grafisch an. Dieser Kreis bedeutet, dass PI -Elektronen mit allen Atomen im Molekül verbunden sind. Diese Delokalisierung lässt den Benzolring chemische Bindungen mit ähnlichen Bindungslängen aufweisen.
Was ist Resonanz?
Resonanz ist ein Konzept in der Chemie, das die Wechselwirkung zwischen einsamen Elektronenpaaren und Bindungselektronenpaaren einer Verbindung beschreibt. Der Resonanzeffekt hilft, die tatsächliche chemische Struktur dieser organischen oder anorganischen Verbindung zu bestimmen. Dieser Effekt erscheint in Verbindungen mit Doppelbindungen und einsamen Elektronenpaaren. Darüber hinaus verursacht dieser Effekt die Polarität von Molekülen.
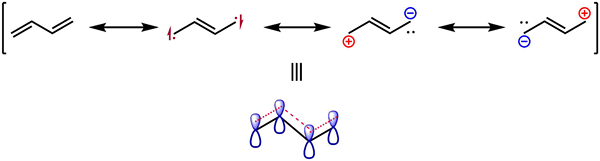
Abbildung 02: Resonanzstrukturen von Butadiene
Der Resonanzeffekt zeigt die Stabilisierung einer chemischen Verbindung durch Delokalisierung von Elektronen in PI -Bindungen. Im Allgemeinen können sich die Elektronen in Molekülen um Atomkerne bewegen, da ein Elektron keine feste Position innerhalb der Atome aufweist. Daher können die einsamen Elektronenpaare zu PI -Bindungen wechseln und umgekehrt. Dies geschieht, um einen stabilen Zustand zu erhalten. Dieser Elektronenbewegungsprozess wird als Resonanz bezeichnet. Darüber hinaus können wir Resonanzstrukturen verwenden, um die stabilste Struktur eines Moleküls zu erhalten.
Ein Molekül kann mehrere Resonanzstrukturen aufweisen, die auf der Anzahl der einsamen Paare und PI -Bindungen in diesem Molekül basieren. Alle Resonanzstrukturen eines Moleküls haben die gleiche Anzahl von Elektronen und die gleiche Anordnung von Atomen. Die tatsächliche Struktur dieses Moleküls ist eine Hybridstruktur in allen Resonanzstrukturen. Es gibt zwei Arten von Resonanzeffekten: positiver Resonanzeffekt und negativer Resonanzeffekt.
Der positive Resonanzeffekt erklärt die Resonanz, die in Verbindungen mit einer positiven Ladung gefunden werden kann. Positiver Resonanzeffekt hilft, die positive Ladung in diesem Molekül zu stabilisieren. Negativer Resonanzeffekt erklärt die Stabilisierung einer negativen Ladung in einem Molekül. Die Hybridstruktur, die unter Berücksichtigung von Resonanz erhalten wird.
Was ist der Unterschied zwischen Delokalisierung und Resonanz?
Delokalisierung und Resonanz sind zwei verwandte chemische Konzepte. Der Hauptunterschied zwischen Delokalisierung und Resonanz besteht darin, dass die Delokalisierung auf Elektronen im gesamten Bereich eines Moleküls verteilt und nicht an ein einzelnes Molekül gebunden ist, während sich Resonanz auf die Stabilisierung eines Moleküls aufgrund der Delokalisierung von Elektronen bezieht.
Darüber hinaus tritt die Delokalisierung in Molekülen mit alternativen Einzelbindungen und Doppelbindungen oder Dreifachbindungen auf, während Resonanz in konjugierten Systemen oder Moleküle mit beweglichen elektrischen Ladungen auftritt.
Die folgende Infografik fasst die Unterschiede zwischen Delokalisierung und Resonanz zusammen.
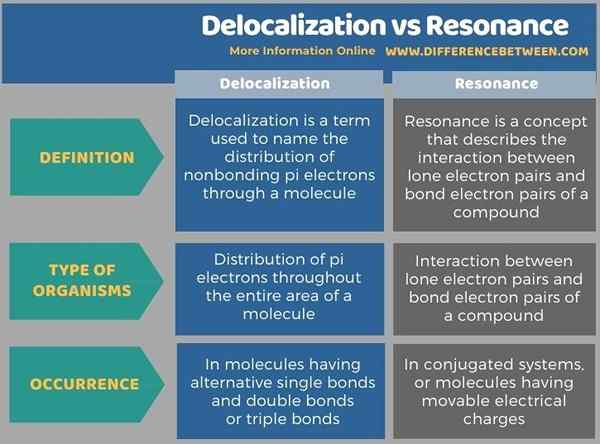
Zusammenfassung -Delokalisierung gegen Resonanz
Delokalisierung und Resonanz sind verwandte chemische Konzepte. Der Resonanzeffekt wird unter Verwendung der Elektronendelokalisierung chemischer Verbindungen erklärt. Der Hauptunterschied zwischen Delokalisierung und Resonanz besteht darin, dass die Delokalisierung sich auf die Elektronen bezieht, die über den gesamten Bereich eines Moleküls verteilt sind, anstatt an ein einzelnes Molekül zu binden, während Resonanz auf die Stabilisierung eines Moleküls aufgrund der Delokalisierung von Elektronen bezieht.
Referenz:
1. „Delokalisierung von Elektronen.”Libretexten. Hier verfügbar.
Bild mit freundlicher Genehmigung:
1. "Delokalisierung updatiert" von Alsosaid1987-eigene Arbeit (CC BY-SA 4.0) über Commons Wikimedia
2. "Butadiene-Resonanz" von Alsosaid1987-eigene Arbeit (CC BY-SA 4.0) über Commons Wikimedia


