Unterschied zwischen EDTA und EGTA
EDTA gegen EGTA
EDTA und EGTA sind beide Chelat -Agenten. Beide sind Polyamino -Carboxsäuren und haben mehr oder weniger die gleichen Eigenschaften.
EDTA
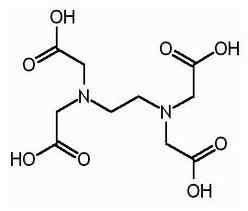
EDTA ist der verkürzte Name für Ethylen -Diamin -Tetraessigsäure. Es ist auch als (Ethylendinitrilo) Tetraessigsäure bekannt. Im Folgenden finden Sie die Struktur von EDTA.

Das EDTA -Molekül hat sechs Stellen, an denen ein Metallion gebunden werden kann. Es gibt zwei Aminogruppen und vier Carboxylgruppen. Die beiden Stickstoffatome von Aminogruppen haben jeweils ein ungesandes Elektronenpaar. EDTA ist ein Hexadentat -Ligand. Außerdem ist es ein Chelatmittel aufgrund der Fähigkeit, Metalleionen zu sequestrieren. EDTA bildet Chelate mit allen Kationen mit Ausnahme von Alkali -Metallen, und diese Chelate sind ausreichend stabil. Die Stabilität ergibt sich aus den verschiedenen Komplexstellen innerhalb des Moleküls, die zu einem käfigähnlichen Struktur führen, der das Metallion umgibt. Dies isoliert das Metallionen aus Lösungsmittelmolekülen und verhindern so die Solvatation. Die Carboxylgruppe von EDTA kann Spendenprotonen dissoziieren; Daher hat EDTA saure Eigenschaften. Die verschiedenen EDTA -Arten werden als h abgekürzt4Y, h3Y-, H2Y2-, HY3- Andy4-. Bei sehr niedrigem pH -Wert (saurem Medium) die protonierte Form von EDTA (H4Y) ist vorherrschend. Im Gegensatz dazu bei hohem pH -Wert (Basismedium), vollständig deprotonierte Form (y4-) überwiegt. Und wenn sich der pH -Wert von niedrigem pH zum hohen pH -Wert ändert, vorherrschen andere Formen von EDTA in bestimmten pH -Werten vorherrschen. EDTA ist als vollständig protonierter Form oder entweder Salzform erhältlich. Disodium edta und calcium disatrium edta sind die häufigsten Salzformen erhältlich. Die freie Säure h4Y und das Dihydrat des Natriumsalzes na2H2Y.2H2O sind im Handel in der Reagenzusqualität erhältlich.
Beim Auflösen in Wasser wirkt EDTA wie eine Aminosäure. Es existiert als doppelter Zwitterion. Bei dieser Gelegenheit ist die Nettoladung Null und es gibt vier dissoziierbare Protonen (zwei Protonen sind mit den Carboxylgruppen und zwei mit Amingruppen verbunden). EDTA wird häufig als komplexometrische Titrantin verwendet. Lösungen von EDTA sind als Titrant wichtig, da es sich mit Metallionen in einem Verhältnis von 1: 1 verbindet, unabhängig von der Ladung des Kationen. EDTA wird auch als Konservierungsmittel für biologische Proben verwendet. Die geringen Mengen von Metallionen, die in biologischen Proben vorhanden sind, und Lebensmittel können die Luftoxidation von Verbindungen in den Proben katalysieren. EDTA komplexe diese Metallionen dicht komplexe und verhindern so, dass sie Luftoxidation katalysieren. Deshalb kann als Konservierungsmittel verwendet werden.
EGTA
EGTA ist der abgekürzte Begriff für Ethylenglykol -Tetraessigsäure.Es ist ein Chelatmakler und ähnlich wie EDTA. EGTA hat eine höhere Affinität zu Calciumionen als Magnesiumionen. EGTA hat die folgende Struktur.
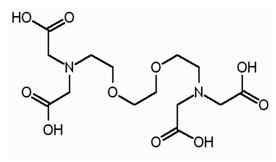
Ähnlich wie bei EDTA hat EGTA auch vier Carboxylgruppen, die bei Dissoziation vier Protonen produzieren können. Es gibt zwei Amingruppen und die beiden Stickstoffatome von Aminogruppen haben in jedem ein ungeschütztes Elektronenpaar. EGTA kann als Puffer verwendet werden, um dem pH -Wert einer lebenden Zelle zu ähneln. Diese Eigenschaft von EGTA ermöglicht ihre Verwendung in der Tandem -Affinitätsreinigung, eine Proteinreinigungstechnik.
| Was ist der Unterschied zwischen EDTA und EGTA? • EDTA ist Ethylen -Diamin -Tetraessigsäure und EGTA ist Ethylenglykoltetraessigsäure. • EGTA hat ein höheres Molekulargewicht als EDTA. • Außer den vier Carboxylgruppen, zwei Aminogruppen, hat EGTA auch zwei weitere Sauerstoffatome mit nicht zusammengestellten Elektronen. • EGTA hat eine höhere Affinität zu Calciumionen im Vergleich zu EDTA. Und EDTA hat eine höhere Affinität zu Magnesiumionen im Vergleich zu EGTA. • EGTA hat einen höheren Siedepunkt als EDTA. |


