Unterschied zwischen elektrischem und kovalenter Bindung
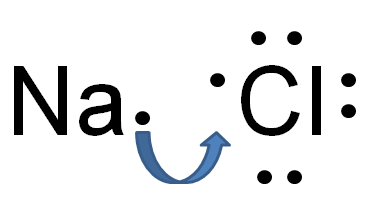
Der Hauptunterschied zwischen elektrischem und kovalenter Bindung besteht darin Die elektralente Bindung erfolgt durch Übertragen von Elektronen von einem Atom auf ein anderes wohingegen Kovalente Bindung tritt infolge der gemeinsamen Valenzelektronen zwischen Atomen auf. Eine ionische Bindung wird auch als elektralente Bindung bezeichnet. Valenzelektronen, die Elektronen in den äußersten Schalen eines Atoms sind, sind an beiden Arten der chemischen Bindung beteiligt.
Die chemische Bindung ist der Schlüssel zur Bildung verschiedener Arten von chemischen Verbindungen. Es wirkt als Klebstoff, um Atome oder Moleküle zusammenzuhalten. Der Hauptzweck der chemischen Bindung besteht darin, eine stabile chemische Verbindung herzustellen. Wenn sich eine chemische Bindung bildet, wird Energie freigesetzt und bildet eine stabile Verbindung. Es gibt drei Haupttypen chemischer Bindungen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist eine elektrische Bindung
3. Was ist eine kovalente Bindung?
4. Seite an Seitenvergleich - elektrisch gegen kovalente Bindung
5. Zusammenfassung
Was ist eine elektrische Bindung?
Elektrovalente oder ionische Bindung ist eine Art chemischer Bindung, die sich aus der Übertragung von Elektronen von einem Atom auf ein anderes enthält. Diese Übertragung bewirkt, dass ein Atom positiv aufgeladen wird und das andere Atom negativ aufgeladen wird. Das Elektronendonoratom wird positiv aufgeladen; Daher wird es als Kation bezeichnet, während das Elektronenatom negativ geladen wird und der Anion genannt wird. Eine elektrostatische Anziehungskraft zwischen diesem Kation und Anion entsteht aufgrund der entgegengesetzten elektrischen Ladungen. Der große Unterschied in der Elektronegativität zwischen den beiden Atomen verursacht diese Bindung. Sowohl metallische als auch nicht-metallische Atome sind an dieser Bindung beteiligt.
Keine der elektrisch -Bindungen sind jedoch reine ionische Bindungen. Jede ionische Verbindung kann einen gewissen Prozentsatz der kovalenten Bindung haben. Somit zeigt es, dass eine ionische Verbindung einen größeren ionischen Charakter und einen geringen kovalenten Charakter hat. Es gibt jedoch einige Verbindungen mit einem beträchtlichen Kovalentcharakter. Diese Art der Bindung wird als polare kovalente Bindungen bezeichnet.
Die Merkmale von Verbindungen, die aus der elektrovalenten Bindung gebaut werden. Bei der Betrachtung der physikalischen Eigenschaften können typischerweise höhere Siedepunkte und Schmelzpunkte beobachtet werden. Aber die Löslichkeit in Wasser und die Eigenschaft für elektrische Leitfähigkeit ist erheblich hoch. Beispiele für Verbindungen mit ionischen Bindungen können Halogenide von Metallen, Metallenoxide, Metallensulfide usw. umfassen.
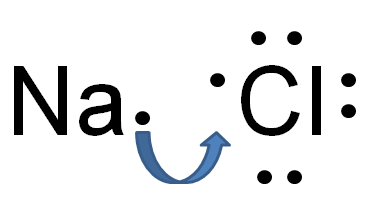
Abbildung 01: Elektrovalente Bindung
Was ist eine kovalente Bindung??
Eine kovalent. Diese Elektronenteilung tritt aufgrund eines geringen Elektronegativitätsunterschieds zwischen den beiden an der Bindung beteiligten Atomen auf. Bei der kovalenten Bindung sind typische Nichtmetallatome beteiligt. Diese Atom. Das liegt daran, dass eine unvollständige Elektronenkonfiguration das bestimmte Atom instabil macht. Im Gegensatz zur ionischen Bindung kann die kovalente Bindung einzelne Doppelbindungen oder Dreifachbindungen zwischen zwei Atomen aufweisen. Diese Bindungen werden so gebildet, dass die beiden Atome der Oktettregel befolgen. Die Bindung erfolgt über die Überlappung von Atomorbitalen. Eine einzige Bindung wird gebildet, wenn zwei Elektronen geteilt werden. Eine Doppelbindung wird gebildet, wenn vier Elektronen geteilt werden. Das Teilen von sechs Elektronen kann zu einer dreifachen Bindung führen.
Die Eigenschaften von Verbindungen mit kovalenten Bindungen umfassen eine starke Bindung zwischen zwei Atomen aufgrund ähnlicher Elektronegativitätswerte. Daher sind Löslichkeit und elektrische Leitfähigkeit (im löslichen Zustand) schlecht oder fehlend. Diese Verbindungen haben auch niedrigere Schmelzpunkte und Siedepunkte im Vergleich zu ionischen Verbindungen. Eine Reihe von organischen und anorganischen Verbindungen kann als Beispiele für Verbindungen mit kovalenter Bindung aufgenommen werden.
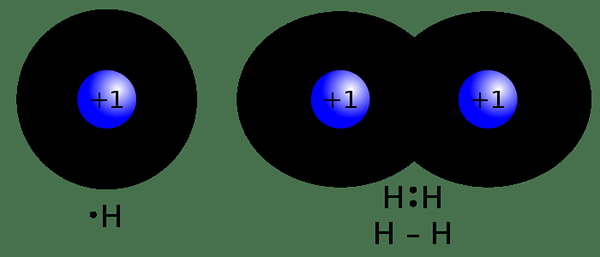
Abbildung 02: kovalente Bindung
Was ist der Unterschied zwischen elektralenter Bindung und kovalenter Bindung?
Elektralente Bindung gegen kovalente Bindung | |
| Elektrovalente Bindung ist eine chemische Bindung zwischen zwei Atomen aufgrund einer Übertragung von Elektronen von einem Atom zum anderen. | Kovalente Bindung ist eine Art chemischer Bindung, die aufgrund des Teilens von Elektronenpaaren zwischen Atomen auftritt. |
| Metalle gegen Nicht-Metalle | |
| Elektrovalente Bindungen können zwischen Metallen und Nichtmetallen beobachtet werden. | Kovalente Bindungen können typischerweise zwischen zwei Nicht-Metallen beobachtet werden. |
| Unterschied in der Elektronegativität | |
| Der Unterschied in der Elektronegativität zwischen zwei Atomen ist bei der elektralenten Bindung höher. | Der Unterschied in der Elektronegativität zwischen zwei Atomen ist vergleichsweise niedriger. |
| Löslichkeit in Wasser und elektrische Leitfähigkeit | |
| Löslichkeit in Wasser und die elektrische Leitfähigkeit sind in Verbindungen mit elektralenter Bindung höher. | Löslichkeit in Wasser und elektrische Leitfähigkeit ist in Verbindungen mit kovalenter Bindung vergleichsweise geringer. |
| Koch- und Schmelzpunkte | |
| Kochen- und Schmelzpunkte sind für die elektralente Bindung höher. | Kochen- und Schmelzpunkte sind für die kovalente Bindung vergleichsweise niedriger. |
Zusammenfassung -elektrisch gegen kovalente Bindungen
Elektrovalente und kovalente Bindungen sind zwei Arten von chemischen Bindungen, die sich voneinander unterscheiden. Der Hauptunterschied zwischen elektrisch -und kovalenten Bindungen ist ihre Natur; Die elektralente Bindung ist eine Art elektrostatischer Anziehung zwischen zwei Atomen.
Referenz:
1. „Elektrovalente Bindung.”EmedicalPrep. N.P., N.D. Netz. 25. Mai 2017.<>
2.”Die kovalente Bindung .Abteilungsgruppen für chemische Bildung. Purdue University, n.D. Netz. 25. Mai 2017.<>
3."Chemische Bindungen.Khan Academy, n.D. Netz. 25. Mai 2017. <>
Bild mit freundlicher Genehmigung:
1. "NaCl Ionic Bond" von Mhowison - eigene Arbeit (öffentlich zugänglich) über Commons Wikimedia
2. "Kovalente Bindung Wasserstoff" von Jacek FH - eigene Arbeit (CC BY -SA 3.0) über Commons Wikimedia


