Unterschied zwischen Enthalpie und Hitze
Der Schlüsselunterschied Zwischen Enthalpie und Hitze ist das Enthalpie ist die Wärmemenge, die während einer chemischen Reaktion bei konstantem Druck übertragen wird, während Wärme eine Energieform ist.
Zu den Studienzwecken in der Chemie teilen wir das Universum in zwei: ein System und eine Umgebung. System ist Gegenstand unserer Untersuchung, während der Rest die Umgebung ist. Wärme und Enthalpie sind zwei Begriffe, die den Energiefluss und die Eigenschaften eines Systems beschreiben.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Enthalpie
3. Was ist Hitze
4. Seite an Seite Vergleich -Enthalpie gegen Wärme in tabellarischer Form
5. Zusammenfassung
Was ist Enthalpie?
In der Thermodynamik ist die Gesamtenergie eines Systems die interne Energie. Interne Energie legt die gesamte kinetische und potentielle Energie von Molekülen im System fest. Die interne Energie eines Systems kann entweder durch die Arbeit am System oder das Erhitzen geändert werden. Die Änderung der inneren Energie ist jedoch nicht gleich der Energie, die als Wärme überträgt, wenn das System in der Lage ist, sein Volumen zu ändern.
Enthalpy ist eine thermodynamische Eigenschaft und wir können es durch H bezeichnen. Die mathematische Beziehung für diesen Begriff lautet wie folgt:
H = U + PV
Hier ist H enthalpy und u ist die innere Energie, p ist der Druck und V ist das Volumen des Systems. Diese Gleichung zeigt, dass die als Wärme bei konstante Druck gelieferte Energie gleich der Änderung der Enthalpie ist. Der Begriff PV macht die vom System erforderliche Energie aus, um das Volumen gegen den konstanten Druck zu ändern. Daher ist Enthalpie im Grunde die Hitze einer Reaktion bei konstantem Druck.

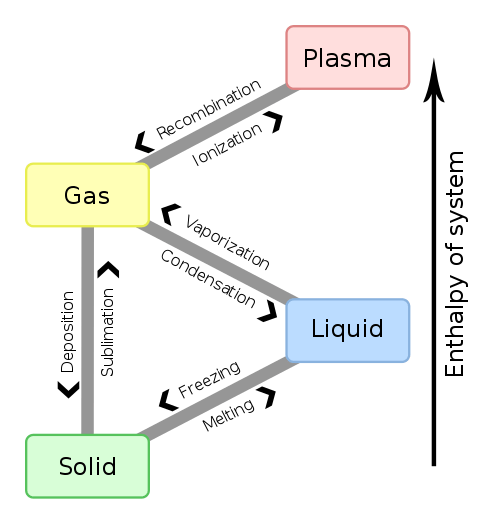
Abbildung 01: Enthalpieänderungen für Phasenveränderungen der Materie
Darüber. Wenn dieser Wert negativ ist, ist die Reaktion exotherm. Wenn der Wert positiv ist, wird die Reaktion als endotherm bezeichnet. Die Änderung der Enthalpie zwischen jedem Paar von Reaktanten und Produkten ist unabhängig vom Weg zwischen ihnen. Darüber hinaus hängt die Enthalpieänderung von der Phase der Reaktanten ab. Wenn beispielsweise Sauerstoff- und Wasserstoffgase zur Herstellung von Wasserdampf reagieren, beträgt die Enthalpieänderung -483.7 kj. Wenn dieselben Reaktanten jedoch auf flüssiges Wasser reagieren, beträgt die Enthalpie -Änderung -571.5 kj.
Was ist Hitze?
Die Kapazität eines Systems, um zu arbeiten, ist die Energie dieses Systems. Wir können am System arbeiten oder das System kann funktionieren, was dazu führt, dass die Energie des Systems entsprechend erhöht oder verringert wird. Energie eines Systems kann nicht nur durch die Arbeit selbst auf andere Weise geändert werden. Wenn sich die Energie eines Systems infolge der Temperaturdifferenz zwischen dem System und seiner Umgebung ändert, beziehen wir uns auf die als Wärme übertragene Energie (q). Das heißt, Energie wurde als Wärme übertragen.

Die Wärmeübertragung erfolgt von hoher Temperatur auf niedrige Temperatur, was entsprechend einem Temperaturgradienten entspricht. Darüber hinaus wird dieser Prozess fortgesetzt, bis die Temperatur zwischen dem System und der Umgebung gleich auf das gleiche Niveau liegt. Es gibt zwei Arten von Wärmeübertragungsprozessen. Sie sind endotherme Prozesse und exotherme Prozesse. Der endotherme Prozess ist ein Prozess, bei dem Energie in das System aus der Umgebung als Wärme eindringt, während ein exothermer Prozess eins ist, bei dem Wärme vom System auf die Umgebung als Wärme übertragen wird.
Was ist der Unterschied zwischen Enthalpie und Hitze?
In den meisten Fällen verwenden wir die Begriffe Enthalpie und Wärme austauschbar, aber es gibt einen geringfügigen Unterschied zwischen Enthplay und Hitze. Der Hauptunterschied zwischen Enthalpie und Wärme besteht darin, dass Enthalpie die während einer chemischen Reaktion bei konstante Druck übertragene Wärmemenge beschreibt, während Wärme eine Energieform ist. Darüber hinaus ist Enthalpie eine Funktion des Staates, während Wärme nicht da ist, da Wärme keine intrinsische Eigenschaft eines Systems ist. Darüber hinaus können wir Enthalpie nicht direkt messen, daher müssen wir es durch Gleichungen berechnen. Wir können jedoch Wärme direkt als Temperaturänderung messen.
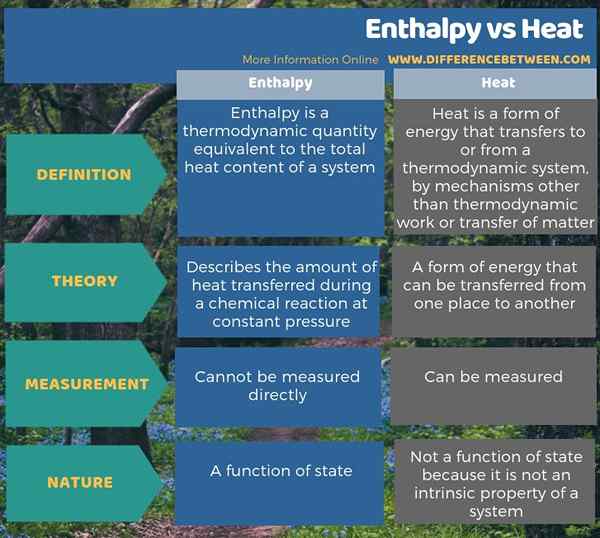
Zusammenfassung -Enthalpie gegen Hitze
Wir verwenden häufig die Begriffe Enthalpie und Wärme austauschen.
Referenz:
1. Helmenstine, Anne Marie. „Enthalpie -Definition in Chemie und Physik.”Thoughtco, August. 22, 2019, hier erhältlich
Bild mit freundlicher Genehmigung:
1. „Phasenänderung - en.”Von F l a n k e r, Penubag - eigene Arbeit (öffentlich zugänglich) über Commons Wikimedia
2. "Fire Flare-up Heat Free Picture" (CC0) über Needpix.com


