Unterschied zwischen Gleichgewicht und Steady -Zustand
Der Schlüsselunterschied Zwischen Gleichgewicht und stationärem Zustand befindet sich das Im Gleichgewicht werden die Konzentrationen aller Komponenten konstant gehalten, während im stationären Zustand nur einige Komponenten konstant gehalten werden.
Wenn ein oder mehrere Reaktanten in Produkte umgewandelt werden, können sie unterschiedliche Modifikationen und Energieveränderungen durchlaufen. Die chemischen Bindungen in den Reaktanten sind gebrochen, und es werden neue Bindungen gebildet, um Produkte zu erzeugen, die sich völlig von den Reaktanten unterscheiden. Das nennen wir eine chemische Reaktion. Gleichgewicht und Steady -State sind wichtige chemische Konzepte in Bezug auf verschiedene chemische Reaktionen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Gleichgewicht
3. Was ist stationärer Zustand
4. Seite für Seitenvergleich - Gleichgewicht gegenüber dem Steady -Stadium in tabellarischer Form
5. Zusammenfassung
Was ist Gleichgewicht?
Einige Reaktionen sind reversibel, während einige Reaktionen irreversibel sind. In einer Reaktion werden Reaktanten in Produkte umgewandelt. Bei einigen Reaktionen erzeugen die Reaktanten erneut aus den Produkten. Wir nennen diese Art von Reaktionen als reversibel. Bei irreversiblen Reaktionen regenerieren sie nach der Umwandlung der Reaktanten in Produkte nicht wieder von Produkten.
Bei einer reversiblen Reaktion nennen wir es, wenn Reaktanten in Produkte umgewandelt werden. Wenn Produkte in Reaktanten umgewandelt werden, nennen wir es eine Rückwärtsreaktion. Wenn die Rate der Vorwärts- und Rückwärtsreaktionen gleich ist, liegt die Reaktion im Gleichgewicht auf. Daher ändert sich die Menge an Reaktanten und Produkten über einen bestimmten Zeitraum nicht.

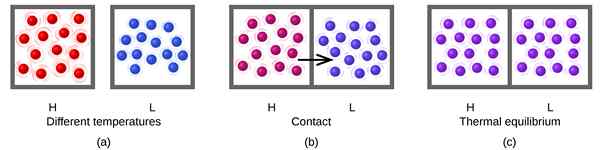
Abbildung 01: Wärme Gleichgewicht
Reversible Reaktionen neigen immer dazu, zum Gleichgewicht zu kommen und dieses Gleichgewicht zu behalten. Wenn sich das System im Gleichgewicht befindet, müssen die Produktmenge und die Reaktanten nicht unbedingt gleich sein. Es kann eine höhere Menge an Reaktanten geben als Produkte oder umgekehrt. Die einzige Anforderung in einer Gleichgewichtsgleichung besteht darin. Für eine Reaktion im Gleichgewicht können wir eine Gleichgewichtskonstante definieren, die dem Verhältnis zwischen der Produktkonzentration und der Konzentration von Reaktionen entspricht.
Was ist stationärer Zustand?
Betrachten Sie eine Reaktion, bei der Reaktant A über ein Zwischenprodukt b an das Produkt C geht. In einer solchen Reaktion wird B durch a gebildet und erfährt dann einen Abzug, um C zu bilden. Bevor die Reaktion beginnt, gibt es nur A, und B beginnt sich langsam aufzubauen. Mit der Zeit wird die Menge von A jedoch reduziert und C erhöht, aber die Menge an B bleibt im Laufe der Zeit ungefähr gleich. In diesem Zustand wird es sobald sich mehr B bildet. Somit ist die Syntheserate von B = Verbrauchsrate von B.
A ⟶ b ⟶ c
Annahme des stationären Zustands: D (b)/dt = 0.
Was ist der Unterschied zwischen Gleichgewicht und stationärem Zustand?
Gleichgewicht und Steady -State sind wichtige chemische Konzepte. Der Schlüsselunterschied zwischen Gleichgewicht und Steady -State besteht darin, dass im Gleichgewicht die Konzentrationen aller Komponenten konstant gehalten werden, während im stationären Zustand nur einige Komponenten konstant gehalten werden. Im Gleichgewicht sind die Komponentenkonzentrationen konstant, da die Reaktionsgeschwindigkeiten bei der Vorwärts- und Rückwärtsreaktion gleich sind. Im stationären Zustand sind nur einige Komponenten konstant, da seine Syntheserate und Verbrauchsrate gleich sind. Dafür müssen die Reaktionen nicht unbedingt im Gleichgewicht liegen.
Zusammenfassung -Gleichgewicht gegen den stationären Zustand
Gleichgewicht und Steady -State sind wichtige chemische Konzepte. Der Schlüsselunterschied zwischen Gleichgewicht und Steady -Zustand besteht darin, dass im Gleichgewicht die Konzentrationen aller Komponenten konstant gehalten werden, während im stationären Zustand nur einige Komponenten konstant gehalten werden.
Referenz:
1.Helmenstine, Anne Marie. „Chemisches Gleichgewicht bei chemischen Reaktionen.”Thoughtco, Februar. 3, 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "CNX Chem 05 01 Heattrans1" von OpenStax - (CC von 4.0) über Commons Wikimedia


