Unterschied zwischen freier Radikalersubstitution und zusätzlicher Radikalzusatz
Der Schlüsselunterschied zwischen freier Radikalersubstitution und Addition des freien Radikals ist, dass die Substitution für freie Radikale den Austausch einer funktionellen Gruppe durch eine andere funktionelle Gruppe beinhaltet, während die Zugabe von freier Radikale die Zugabe einer neuen funktionellen Gruppe zu einem Molekül beinhaltet.
Ein freies Radikal kann ein Atom, ein Molekül oder ein Ion sein, das aus einem ungepaarten Valenzelektron besteht. Es gibt zwei Haupttypen radikaler Reaktionen: Substitution der freien Radikale und Additionsreaktionen für freie Radikale.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist ein freier Radikal
3. Was ist freie radikale Substitution
4. Was ist freie radikale Ergänzung
5. Freie radikale Substitution gegen freie Radikale in tabellarischer Form
6. Zusammenfassung - Substitution für freie Radikale im Vergleich zum freien Radikalzusatz
Was ist ein freier Radikal?
Ein freies Radikal kann ein Atom, ein Molekül oder ein Ion sein, das aus einem ungepaarten Valenzelektron besteht. Normalerweise können diese ungepaarten Elektronen die freien Radikale sehr chemisch reaktiv machen. Es kann jedoch einige Ausnahmen geben. Aufgrund ihrer hohen Reaktivität neigen die meisten freien Radikale dazu, spontan zu dimerisieren. Daher haben sie ein sehr kurzes Leben.
Was ist freie radikale Substitution?
Die Substitution des freien Radikals ist eine Art Substitutionsreaktion, die freie Radikale als reaktiv. Reaktive Zwischenprodukte sind kurzlebige, hohe Energie und hohe reaktive Moleküle. Diese Moleküle bilden sich während einer chemischen Reaktion, die dazu neigt, schnell in stabilere Moleküle umzuwandeln. Darüber hinaus ist eine Substitutionsreaktion eine Art chemischer Reaktion, bei der eine funktionelle Gruppe in einer chemischen Verbindung tendenziell durch eine andere funktionelle Gruppe ersetzt wird.

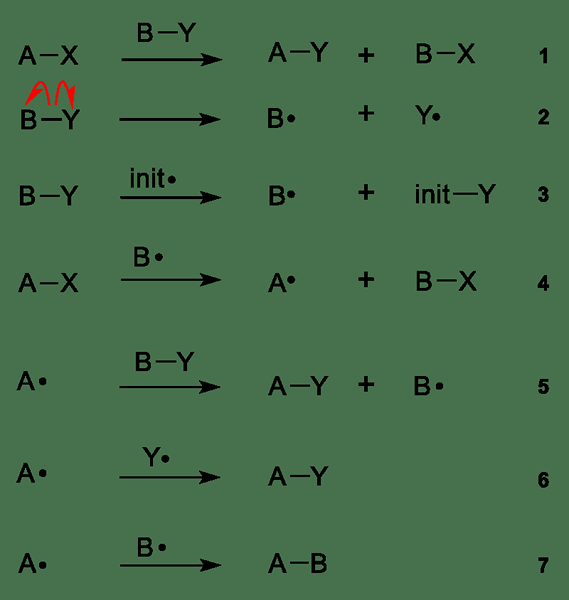
Abbildung 01: Verschiedene Schritte in freien Radikalen Reaktionen
Das obige Bild zeigt die Schritte der readikalen Reaktionen im Allgemeinen an; Schritt 2 und 3 werden als Initiationsreaktionen bezeichnet, bei denen sich freie Radikale durch Homolyse bildet. Die Homolyse kann mit Wärme oder UV -Licht und radikalen Initiatoren erzielt werden, e.G. organische Peroxide, Azoverbindungen usw. Die letzten Schritte 6 und 7 werden gemeinsam als Kündigung bezeichnet. Hier neigt die Radikale dazu, sich mit einer anderen radikalen Spezies zu rekombinieren. Die Radikale reagieren jedoch manchmal weiter, wo die Ausbreitung auftritt. Die Ausbreitung erfolgt aus den Schritten 4 und 5 im obigen Bild.
Einige Beispiele für radikale Substitutionsreaktionen sind die Barton-McCombie-Desoxygenierung, Wohl-Ziegler-Reaktion, Dowd-Beckwith-Reaktion usw.
Was ist freie radikale Ergänzung?
Die Addition der freien Radikale ist eine Art von Additionsreaktion, bei der eine funktionelle Gruppe durch ein reaktives mittleres reaktiv. Diese Art von Addition kann zwischen einer radikalen und einer nicht-radikalen Spezies oder zwischen zwei radikalen Spezies auftreten. Zu den grundlegenden Schritten der Addition des freien Radikals gehören Initiierung, Kettenausbreitung und Kettenbeendigung.
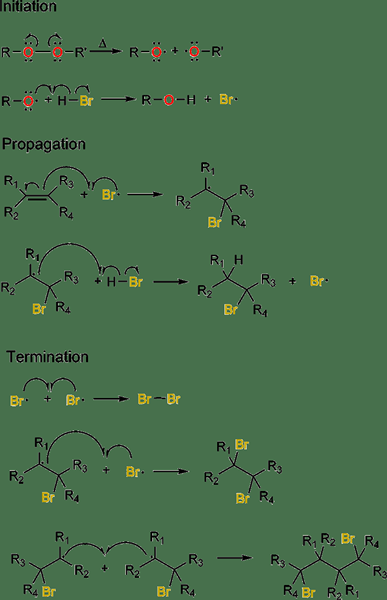
Abbildung 02: radikale Zugabe von HBR auf Alkenen
Während des Initiierungsprozesses wird ein radikaler Initiator für die Initiierung verwendet, bei dem sich eine radikale Spezies aus einem nicht radikalen Vorläufer bildet. Während des Kettenausbreitungsprozesses reagiert ein freies Radikal mit einer nicht-radikalen Spezies, um eine neue radikale Spezies zu erzeugen. Der letzte Schritt ist die Kettenabschluss, bei der die beiden Radikalen miteinander reagieren und eine nicht-radikale Spezies erzeugen. Ein häufiges Beispiel für diese Art von Reaktion umfasst die Meerwein -Arylierung.
In der Regel basieren freie Radkaladditionsreaktionen auf den Reagenzien mit schwachen Bindungen, damit sie sich einer Homolyse unterziehen können, die radikale Spezies bildet. Wenn es starke Bindungen gibt, unterscheidet sich der Reaktionsmechanismus von den üblichen Additionsreaktionen für freie Radikale.
Was ist der Unterschied zwischen freier Radikalersubstitution und zusätzlicher Radikalzusatz?
Ein freies Radikal kann ein Atom, ein Molekül oder ein Ion sein, das aus einem ungepaarten Valenzelektron besteht. Der Hauptunterschied zwischen der Substitution freier Radikale und der Zugabe von freiem Radik besteht darin, dass die Substitution der freien Radikale den Austausch einer funktionellen Gruppe durch eine andere funktionelle Gruppe beinhaltet, während die Zugabe von freier Radikale die Zugabe einer neuen funktionellen Gruppe zu einem Molekül beinhaltet.
Die folgende Abbildung listet die Unterschiede zwischen freien Radikalen und freien Radikalen in tabellarischer Form für Seite für Seitenvergleich auf.
Zusammenfassung -Substitution für freie Radikale im Vergleich zum freien Radikalzusatz
Ein freies Radikal kann ein Atom, ein Molekül oder ein Ion sein, das aus einem ungepaarten Valenzelektron besteht. Der Hauptunterschied zwischen der Substitution freier Radikale und der Zugabe von freiem Radik besteht darin, dass die Substitution der freien Radikale den Austausch einer funktionellen Gruppe durch eine andere funktionelle Gruppe beinhaltet, während die Zugabe von freier Radikale die Zugabe einer neuen funktionellen Gruppe zu einem Molekül beinhaltet.
Referenz:
1. „Was ist freie radikale Substitution?” Chemie -Libretexten, Libretexten, 13. September. 2020, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "FreeradicalSubstitutionGeneraldescr (1)" von V8RIK in englischer Wikipedia (CC BY-SA 3.0) über Commons Wikimedia
2. "Peroxid-freie Radikala-Addition" von Bryn C-über Commons Wikimedia von EN (Public Domain) übertragen


