Unterschied zwischen Geminal- und Vicinal Dihalides
Der Schlüsselunterschied Zwischen Geminal- und Vicinal Dihalides ist das Geminal -Dihalide haben beide Halogenidgruppen, die an dasselbe Kohlenstoffatom gebunden sind, während vicinale Dihalides ihre zwei Halogenidgruppen an zwei benachbarten Kohlenstoffatomen in derselben Verbindung gebunden sind.
Die Begriffe Geminal und Vicinal werden bei chemischen Verbindungen mit Ersatzstoffe verwendet. Diese Begriffe unterscheiden Verbindungen gemäß der Position des Ersatzes im Vergleich zueinander.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind Geminal Dihalides
3. Was sind vicinale Dihalides
4. Seite an Seitenvergleich - Geminal gegen vicinale Dihalides in tabellarischer Form
5. Zusammenfassung
Was sind Geminal Dihalides?
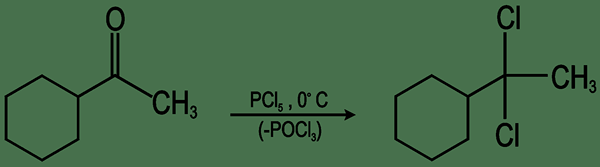
Geminal -Dihalide sind organische Verbindungen, die zwei Halogengruppen enthalten, die an demselben Kohlenstoffatom gebunden sind. Halogenide sind die Anionen von Halogenatomen. Ein Halogen ist ein Atom eines chemischen Elements der Gruppe 7 der Periodenzüchtertabelle. Wenn die beiden Halogenidgruppen an demselben Kohlenstoffatom befestigt sind, macht es die Verbindung an diesem Kohlenstoffpunkt achiral (zeigt keine Spiegelbilder, die nicht superimpusbar sind).

Abbildung 01: Bildung eines Geminal -Dihalids
Darüber hinaus beträgt die Hybridisierung dieses Kohlenstoffatoms entweder SP2 oder SP3. Die Geometrie um dieses Kohlenstoffzentrum ist entweder trigonaler planar (wenn die Hybridisierung des Kohlenstoffatoms SP2 ist) oder tetraedrisch (wenn die Hybridisierung SP3 ist). Der allgemeine Name von Geminal Dihalides ist Alkyliden Dihalid.
Was sind vicinale Dihalides?
Vikinale Dihalide sind organische Verbindungen mit zwei Halogenidgruppen, die an zwei benachbarten Kohlenstoffatomen derselben chemischen Verbindung gebunden sind. Die Halogenidgruppe kann eine der aus Halogenen gebildeten Anionen sein. Wenn die beiden Halidgruppen an demselben Kohlenstoffatom befestigt sind, besteht die Möglichkeit, dass die Verbindung chiral ist, wenn keine zwei ähnlichen Gruppen an demselben Kohlenstoff befestigt sind.
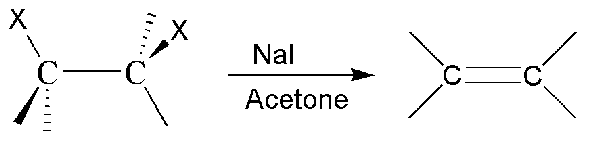
Abbildung 02: Bildung eines vicinalen Dihalids
Darüber hinaus kann die Hybridisierung der Verbindung um diese beiden benachbarten Kohlenstoffatome in Abhängigkeit von der Art der kovalenten Bindungen um sie herum SP, SP2 oder SP3 sein. Wenn beispielsweise eine dreifache Bindung zwischen zwei Kohlenstoffatomen besteht, hat die Verbindung die SP -Hybridisierung und die Geometrie um die Kohlenstoffatome ist linear). In ähnlicher Weise, wenn es eine doppelte Bindung zwischen diesen beiden Kohlenstoffatomen gibt, die die Halogenidgruppen tragen, dann sind dies sp2 hybridisierte Kohlenstoffatome, und die Geometrie um sie herum ist trigonaler planar.
Was ist der Unterschied zwischen Geminal- und Vicinal Dihalides?
Der Schlüsselunterschied zwischen Geminal- und Vicinal -Dihalides besteht darin.
Wenn die beiden Halogenidgruppen an demselben Kohlenstoffatom befestigt sind, macht es die Verbindung an diesem Kohlenstoffpunkt achiral (zeigt keine Spiegelbilder, die nicht superimpusbar sind). Wenn die beiden Halidgruppen an demselben Kohlenstoffatom befestigt sind, besteht die Möglichkeit, dass die Verbindung chiral ist, wenn keine zwei ähnlichen Gruppen an demselben Kohlenstoff befestigt sind.
Bei Geminal -Dihaliden beträgt die Hybridisierung des Kohlenstoffatoms, das die Halogenidgruppen trägt. In vicinalen Dihaliden kann die Hybridisierung der Verbindung um zwei benachbarte Kohlenstoffatome, die die Halogenidgruppen tragen.

Zusammenfassung -Geminal gegen Vicinal Dihalides
Die Begriffe Geminal und Vicinal werden bei chemischen Verbindungen mit Ersatzstoffe verwendet. Diese Begriffe unterscheiden die Verbindungen an der Position von Ersatzstücken im Vergleich zueinander. Der Schlüsselunterschied zwischen Geminal- und Vicinal -Dihalides besteht darin.


