Unterschied zwischen Grahams Erguss- und Diffusionsgesetz
Der Schlüsselunterschied Zwischen Grahams Erguss- und Diffusionsgesetz ist das Grahams Ergussgesetz wird für ein Gas angewendet, das eine Öffnung durchläuft, die kleiner ist.
Grahams Gesetz besagt, dass die Diffusions- oder Ergussrate eines Gases umgekehrt proportional zur Quadratwurzel seiner Molmasse ist. Dieses Gesetz wurde 1848 vom physikalischen Chemiker Thomas Graham entwickelt.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Grahams Ergussgesetz?
3. Was ist Grahams Verbreitungsgesetz
5. Seite an Seitenvergleich - Grahams Gesetz des Ergusss und der Diffusion in tabellarischer Form
6. Zusammenfassung
Was ist Grahams Ergussgesetz??
Grahams Ergussgesetz zeigt an, dass die Diffusions- oder Ergussrate eines Gases umgekehrt proportional zur Quadratwurzel seiner Molmasse ist. Wir können dieses Gesetz als mathematischer Ausdruck wie folgt geben;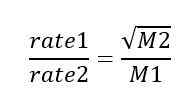
In diesem mathematischen Ausdruck ist Rate1 die Ergussrate eines Gases; Rate2 ist die Ergussrate für ein zweites Gas; M1 ist die Molmasse des ersten Gass, während M2 die Molmasse des zweiten Gases ist. Nach dieser Beziehung diffundiert die Molmasse eines Gases vierfachen der Molmasse eines anderen Gas. Grahams Gesetz ist die Grundlage für die Trennung von Isotopen durch Diffusion (wichtig für die Produktion der Atombombe).
Für den molekularen Erguss von Gasen, die die Bewegung eines Gases gleichzeitig durch ein Loch beinhalten. Es ist jedoch nur ungefähr genau für die Diffusion eines Gases in einem anderen Gas genau, da es die Bewegung eines Gases in ein anderes Gas enthält.
Was ist Grahams Verbreitungsgesetz?
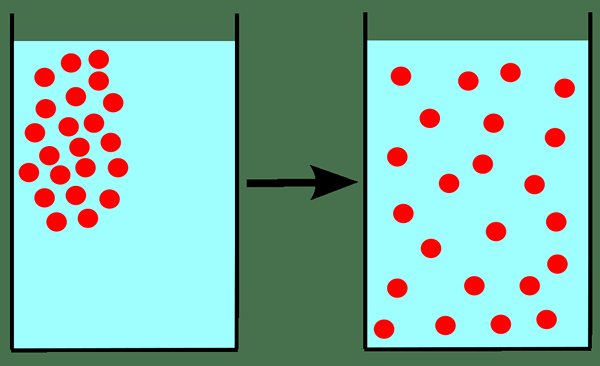
Grahams Diffusionsgesetz ist ein Gesetz in der Chemie, das darauf hinweist. Wenn wir dieses Gesetz für die Verbreitung eines Gases anwenden, müssen wir zunächst wissen, was die Diffusion ist. Die Diffusion bezieht sich auf die allmähliche Mischung von Gasen aufgrund der Bewegung von Gaspartikeln in Abwesenheit einer mechanischen Bewegung wie Rühren.

Abbildung 01: Verbreitung
Dieses Gesetz ist nur ungefähr genau für die Diffusion eines Gases in einem anderen Gas (da es die Bewegung eines Gases in ein anderes Gas enthält).
Was ist der Unterschied zwischen Grahams Ergussgesetz und Diffusion?
Grahams Gesetz besagt, dass die Diffusions- oder Ergussrate eines Gases umgekehrt proportional zur Quadratwurzel seiner Molmasse ist. Der Hauptunterschied zwischen Grahams Ergussgesetz und Diffusion besteht darin, dass das Graham -Ergussgesetz für ein Gas angewendet wird, das eine Öffnung durchläuft, die kleiner als die Gaspartikel ist, während das Graham -Diffusionsgesetz für Gasmoleküle angewendet wird, die sich in einem Behälter zerstreuen. Außerdem ist Grahams Ergussgesetz das genaueste Gesetz für den Erguss, während Grahams Diffusionsgesetz für die Diffusion nur ungefähr genau ist.
Die folgende Infografik fasst den Unterschied zwischen Grahams Erguss und Diffusion zusammen.

Zusammenfassung -Grahams Erließgesetz gegen Diffusion
Grahams Gesetz besagt, dass die Diffusions- oder Ergussrate eines Gases umgekehrt proportional zur Quadratwurzel seiner Molmasse ist. Der Hauptunterschied zwischen Grahams Ergussgesetz und Diffusion besteht darin, dass das Graham -Ergussgesetz für ein Gas angewendet wird, das eine Öffnung durchläuft, die kleiner als die Gaspartikel ist, während das Graham -Diffusionsgesetz für Gasmoleküle angewendet wird, die sich in einem Behälter zerstreuen.
Referenz:
1. “2.9: Grahams Gesetze der Diffusion und Erguss.” Chemie -Libretexten, Libretexten, 14. Juli 2020, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Diffusion" durch JRPOL - eigene Arbeit (CC von 3.0) über Commons Wikimedia


