Unterschied zwischen Metallen der Gruppe 1 und Übergangsmetallen
Der Schlüsselunterschied Zwischen Metallen der Gruppe 1 und Übergangsmetallen ist das Metalle der Gruppe 1 bilden farblose Verbindungen, während Übergangsmetalle farbenfrohe Verbindungen bilden.
Gruppe -1 -Metalle werden auch als Alkali -Metalle bezeichnet, da diese Elemente alkalische Verbindungen bilden können. Gruppe 1 des Periodensystems enthält jedoch Wasserstoff, der ein Nichtmetall ist. Übergangsmetalle hingegen sind D -Blockelemente, aber nicht alle D -Blockelemente sind Übergangsmetalle. Metalle und Übergangsmetalle der Gruppe 1 ähneln in der Tatsache, dass beide ungepaarte Elektronen haben.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind Metalle der Gruppe 1
3. Was sind Übergangsmetalle
4. Seite für Seitenvergleich - Metalle der Gruppe 1 gegen Übergangsmetalle in tabellarischer Form
5. Zusammenfassung
Was sind Metalle der Gruppe 1?
Metalle der Gruppe 1 sind chemische Elemente mit einem ungepaarten Elektron im äußersten S -Orbital mit. Diese Metalle werden als alkalische Metalle bezeichnet, da sie chemische Verbindungen bilden. Wir können diese Elemente in der ersten Spalte des S -Blocks der Periodenzüchter beobachten. Die Mitglieder dieser Gruppe 1 -Metalle sind wie folgt:
- Lithium (li)
- Natrium (Na)
- Kalium (k)
- Rubidium (RH)
- Cäsium (CS)
- Francium (Fr)
Gruppe -1 -Metalle sind alle glänzend, hochreaktiv und sehr weich (wir können sie leicht mit einem einfachen Messer schneiden). Im Allgemeinen zeigen die Metalle in dieser Gruppe niedrige Dichten, niedrige Schmelzpunkte, niedrige Siedepunkte und weisen körperzentrierte kubische Kristallstrukturen auf. Darüber hinaus haben sie unterschiedliche Flammenfarben, sodass wir sie leicht unterscheiden können, indem wir eine Probe einem Bunsen -Brenner aussetzen.
Darüber hinaus gibt es einige regelmäßige Unterschiede zwischen den Metallen der Gruppe 1. Zum Beispiel nimmt die Atomgröße der Elemente zu, der Schmelzpunkt und der Siedepunkt abnehmen, die Dichte steigt, die erste Ionisierungsenergie nimmt ab, die Reaktivität nimmt ab usw.
Was sind Übergangsmetalle?
Übergangsmetalle sind chemische Elemente mit Atomen mit ungepaarten D -Elektronen. In diesen Elementen sollten zumindest die stabilen Kationen, die sie bilden. Daher sind die meisten D -Blockelemente Übergangsmetalle. Wir können Skandium und Zink nicht als Übergangsmetalle betrachten, da sie selbst in ihren stabilen Kationen keine ungepaarten Elektronen haben. Diese Atome haben D -Elektronen, aber alle sind gepaarte Elektronen.

Darüber hinaus können Übergangsmetallelemente unterschiedliche Verbindungen mit einer Vielzahl von Farben bilden. Diese Elemente erhalten diese Fähigkeit, da diese Elemente unterschiedliche Oxidationszustände haben können, die sehr farbenfroh sind. Diese unterschiedlichen Oxidationszustände des chemischen Elements können unterschiedliche Farben haben. Darüber hinaus entstehen diese Farben aufgrund von elektronischen D-D-Übergängen. Außerdem sind diese Metalle aufgrund des Vorhandenseins dieser ungepaarten Elektronen entweder paramagnetisch oder ferromagnetisch. Fast alle diese Elemente können sich mit Liganden verbinden, um Koordinierungskomplexe zu bilden.
Was ist der Unterschied zwischen Metallen der Gruppe 1 und Übergangsmetallen?
Gruppe -1 -Metalle und Übergangsmetalle unterscheiden. Das ist; Der Schlüsselunterschied zwischen Metallen der Gruppe 1 und Übergangsmetallen besteht darin, dass die Metalle der Gruppe 1 farblose Verbindungen bilden, während die Übergangsmetalle farbenfrohe Verbindungen bilden.
Darüber hinaus sind die Metalle der Gruppe 1 chemische Elemente mit einem ungepaarten Elektron im äußersten S -Orbital, während die Übergangsmetalle chemische Elemente mit Atomen mit ungepaarten D -Elektronen sind.
Nachfolgend Infografik Tabuliert die Unterschiede zwischen Metallen und Übergangsmetallen der Gruppe 1 ausführlicher.
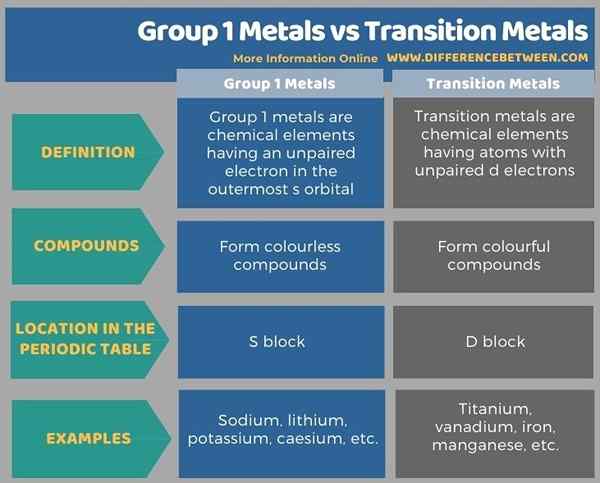
Zusammenfassung -Gruppe 1 Metalle gegen Übergangsmetalle
Gruppe -1 -Metalle und Übergangsmetalle unterscheiden. Der Schlüsselunterschied zwischen Metallen der Gruppe 1 und Übergangsmetallen besteht darin, dass die Metalle der Gruppe 1 farblose Verbindungen bilden, während die Übergangsmetalle farbenfrohe Verbindungen bilden.
Referenz:
1. Baumwolle, f. Albert. "Übergangsmetall.”Encyclopædia Britannica, Encyclopædia Britannica, Inc., 3 Apr. 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Periodenabtischdiagramm mit reaktiven Nichtmetallen" von Sandbh - eigene Arbeit (CC BY -SA 4).0) über Commons Wikimedia
2. Von Benjah-BMM27 angenommen (basierend auf Urheberrechtsansprüchen). - Eigene Arbeit angenommen (basierend auf Urheberrechtsansprüchen)., (Public Domain) über Commons Wikimedia


