Unterschied zwischen Holoenzym und Apoenzym

Schlüsselunterschied - Holoenzym gegen Apoenzym
Enzyme sind biologische Katalysatoren, die die Rate der chemischen Reaktionen im Körper erhöhen. Es sind Proteine, die aus Aminosäuresequenzen bestehen. Enzyme sind an den chemischen Reaktionen beteiligt, ohne konsumiert zu werden. Sie sind spezifisch für Substrate und chemische Reaktionen. Die Funktion des Enzyms wird durch verschiedene nicht-protesinaöse kleine Moleküle unterstützt. Sie sind als Cofaktoren bekannt. Sie helfen Enzymen in ihrer katalytischen Wirkung. Diese Cofaktoren können Metallionen oder Coenzyme sein; Sie können auch entweder anorganische oder organische Moleküle sein. Viele Enzyme benötigen einen Cofaktor, um aktiv zu werden und die katalytische Funktion zu initiieren. Basierend auf der Bindung mit Cofaktor haben Enzyme zwei Formen namens Apoenzym und Holoenzym. Der Schlüsselunterschied zwischen Holoenzym und Apoenzym ist das Apoenzym ist die Proteinkomponente des Enzyms, das inaktiv und nicht an den Cofaktor gebunden ist während Holoenzym ist die Proteinkomponente des Enzyms und des gebundenen Cofaktors, der die aktive Form des Enzyms erzeugt.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Holoenzym
3. Was ist Apoenzym
4. Seite an Seitenvergleich - Holoenzym gegen Apoenzym in tabellarischer Form
5. Zusammenfassung
Was ist Holoenzym?
Enzyme sind Proteine, die biochemische Reaktionen in den Zellen katalysieren. Die meisten Enzyme benötigen ein kleines Nicht -Protein -Molekül, um katalytische Funktionen zu initiieren. Diese Moleküle sind als Cofaktoren bekannt. Cofaktoren sind hauptsächlich anorganische oder organische Moleküle. Cofaktoren werden in zwei Haupttypen namens Metallionen und Coenzyme eingeteilt. Die Bindung des Cofaktors ist wesentlich für die Aktivierung des Enzyms und die Initiierung der chemischen Reaktion. Wenn die Proteinkomponente des Enzyms an den Cofaktor gebunden ist, wird das vollständige Molekül als Holoenzym bekannt. Das Holoenzym ist katalytisch aktiv. Daher bindet es aktiv mit den Substraten und erhöht die Reaktionsgeschwindigkeit. Coenzyme binden lose mit den Enzymen, während prothetische Gruppen eng mit den Apoenzymen binden. Einige Cofaktoren binden an das aktive Zentrum des Enzyms. Bei der Bindung verändert es die Konformation des Enzyms und verbessert die Bindung von Substraten an die aktive Stelle des Enzyms.
DNA -Polymerase und RNA -Polymerase sind zwei Holoenzyme. Die DNA -Polymerase erfordert, dass Magnesiumionen aktiv werden und die DNA -Polymerisation initiieren. RNA -Polymerase benötigt einen Sigmafaktor für seine katalytische Funktion.
Was ist Apoenzym?
Apoenzym ist das Enzym vor der Bindung mit dem Cofaktor. Mit anderen Worten, Apoenzym ist der Proteinteil des Enzyms, dem der Cofaktor fehlt. Apoenzym ist katalytisch inaktiv und unvollständig. Es bildet bei der Kombination mit einem Coenzym ein aktives Enzymsystem und bestimmt die Spezifität dieses Systems für ein Substrat. Es gibt viele Cofaktoren, die mit Apoenzymen binden, um Holoenzyme herzustellen. Gemeinsame Coenzyme sind NAD+, FAD, Coenzym A, B Vitamine und Vitamin C. Gemeinsame Metallionen, die mit Apoenzymen binden, sind Eisen, Kupfer, Kalzium, Zink, Magnesium usw. Cofaktoren binden fest oder locker mit dem Apoenzym, um Apoenzym in Holoenzym umzuwandeln. Sobald der Cofaktor aus dem Holoenzym entfernt wurde, wird er erneut in Apoenzym umgewandelt, das inaktiv und unvollständig ist.
Das Vorhandensein des Cofaktors am aktiven Zentrum des Apoenzyms ist wesentlich, da sie Gruppen oder Stellen bereitstellen, die der Proteinteil des Enzyms nicht besitzt, um die Reaktion zu katalysieren.
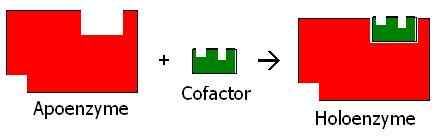
Abbildung 01: Apoenzym und Holoenzym
Was ist der Unterschied zwischen Holoenzym und Apoenzym?
Holoenzym gegen Apoenzym | |
| Holoenzym ist ein aktives Enzym, das aus einem an seinen Cofaktor gebundenen Apoenzym besteht. | Apoenzym ist die Proteinkomponente, der sein Cofaktor fehlt. |
| Cofaktor | |
| Holoenzym ist an seinen Cofaktor gebunden. | Apoenzym ist die Enzymkomponente ohne den Cofaktor. |
| Aktivität | |
| Das Holoenzym ist katalytisch aktiv. | Apoenzym ist katalytisch inaktiv. |
| Vollständigkeit | |
| Das Holoenzym ist vollständig und kann die Reaktion initiieren. | Apoenzym ist unvollständig und kann die Reaktion nicht einleiten. |
| Beispiele | |
| DNA -Polymerase, RNA -Polymerase sind Beispiele für Holoenzym. | Aspartat -Transcarbamoylase ist ein Beispiel für Apoenzym. |
Zusammenfassung -Holoenzym gegen Apoenzym
Enzyme sind biologische Katalysatoren der Zellen. Sie senken die Energie, die für das Auftreten von Reaktion erforderlich ist. Enzyme erhöhen die Reaktionsgeschwindigkeit, indem das Substrat aktiv induziert wird, das in Produkte umgewandelt wird. Sie katalysieren speziell die Reaktionen, ohne in die Reaktionen einzubeziehen. Enzyme bestehen aus Proteinmolekülen. Der Proteinabschnitt des Enzyms ist als Apoenzym bekannt. Apoenzym muss mit nicht proteinssiven kleinen Molekülen gebunden werden, die als Cofaktoren bezeichnet werden, um aktiv zu werden. Wenn Apoenzym mit Cofaktor bindet, wird der Komplex als Holoenzym bekannt. Das Holoenzym ist katalytisch aktiv, um die chemische Reaktion auszulösen. Das Substrat bindet an das Holoenzym, nicht an das Apoenzym. Dies ist der Unterschied zwischen Holoenzym und Apoenzym.
Laden Sie die PDF -Version von Holoenzym vs Apoenzym herunter
Sie können die PDF -Version dieses Artikels herunterladen und ihn für Offline -Zwecke gemäß Zitatnotizen verwenden. Bitte laden Sie die PDF -Version hier den Unterschied zwischen Holoenzym und Apoenzym herunter.
Verweise:
1.Strukturbiochemie/Enzym/Apoenzym und Holoenzym.Strukturbiochemie/Enzym/Apoenzym und Holoenzym - Wikibooks. N.P., N.D. Netz. Hier verfügbar. 12. Juni 2017.
2. BIOCHEMIE. N.P., N.D. Netz. Hier verfügbar. 13. Juni 2017.
Bild mit freundlicher Genehmigung:
1. "Enzyme" von Moniquepena - eigene Arbeit (Public Domain) über Commons Wikimedia


