Unterschied zwischen homogenem und heterogenem Gleichgewicht
Der Schlüsselunterschied zwischen homogenem und heterogenem Gleichgewicht ist das Im homogenen Gleichgewicht befinden sich die Reaktanten und Produkte in derselben Phase der Materie, während im heterogenen Gleichgewicht die Reaktanten und Produkte in verschiedenen Phasen liegen.
Gleichgewicht ist ein Zustand, in dem die Konzentrationen von Reaktanten und Produkten konstant bleiben. Es gibt zwei Arten von Gleichgewichten als homogenes Gleichgewicht und heterogenes Gleichgewicht. Diese beiden Typen unterscheiden sich je nach Phase der Materie der Reaktanten und Produkte im Gleichgewicht.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist homogenes Gleichgewicht
3. Was ist ein heterogenes Gleichgewicht
4. Seite an Seite Vergleich - homogenes vs. Heterogenes Gleichgewicht in tabellarischer Form
5. Zusammenfassung
Was ist homogenes Gleichgewicht?
Das homogene Gleichgewicht ist ein Zustand, in dem sich die Reaktanten und Produkte in derselben Phase der Materie befinden. Normalerweise befinden sich die Reaktanten und Produkte in einer einzigen Lösung. Wir nennen diese Art von Reaktionsgemisch als homogenes Gemisch. Die chemischen Spezies, die sich in dieser Mischung befinden, können Moleküle, Ionen oder eine Kombination von Molekülen und Ionen sein. Darüber hinaus umfasst die Expression für die Gleichgewichtskonstante dieser Reaktionsart die Konzentrationen aller Reaktanten und Produkte. Zum Beispiel ergeben das Mischen von Schwefeldioxidgas und Sauerstoffgas Schwefeltrioxidgas, alle Reaktanten und Produkte befinden sich in der Gasphase. Dann sind die Reaktion und die Gleichgewichtskonstante (k) wie folgt:
2SO2 (g) + Ö2 (g) ⇌ 2so3 (g)
K = [so3 (g)]2/[SO2 (g)]2[Ö2 (g)]

Was ist ein heterogenes Gleichgewicht?
Heterogenes Gleichgewicht ist ein Zustand, in dem sich die Reaktanten und Produkte in verschiedenen Phasen befinden. Dort können die Phasen eine beliebige Kombination aus Feststoff-, Flüssigkeits- und Gasphasen sein. Im Gegensatz zu homogenen Gleichgewichten müssen wir beim Schreiben der Gleichgewichtskonstante für heterogenes Gleichgewicht jedoch die Konzentrationen von Festkörpern und reinen Flüssigkeiten ausschließen. Zum Beispiel ergibt das Mischen von Kohlenstoff in fester Form mit Sauerstoffgas Kohlenmonoxidgas. Dann sind die Reaktion und die Gleichgewichtskonstante (k) wie folgt:
O2(G) + 2c(S) ⇌ 2co(G)
K = [co(G)]2/[Ö2 (g)]
Was ist der Unterschied zwischen homogenem und heterogenem Gleichgewicht?
Gleichgewicht ist ein Zustand, in dem die Konzentrationen von Reaktanten und Produkten konstant bleiben. Es gibt zwei Arten von Gleichgewichten als homogenes Gleichgewicht und heterogenes Gleichgewicht. Der Schlüsselunterschied zwischen homogenem und heterogenem Gleichgewicht besteht darin.
Bei der Bestimmung der Gleichgewichtskonstante für homogene Gleichgewichte müssen wir außerdem Konzentrationen aller Reaktanten und Produkte einbeziehen; Bei der Bestimmung der heterogenen Gleichgewichte müssen wir jedoch die Konzentrationen von Festkörpern und reinen Flüssigkeiten ausschließen und müssen die Konzentrationen anderer Reaktanten und Produkte verwenden. Als Beispiel 2SO2 (g) + Ö2 (g) ⇌ 2so3 (g) ist ein homogenes Gleichgewicht und o2 (g) + 2c(S) ⇌ 2co(G) ist ein Beispiel für ein heterogenes Gleichgewicht.
Unten infografisch tabuliert der Unterschied zwischen homogenem und heterogenem Gleichgewicht.
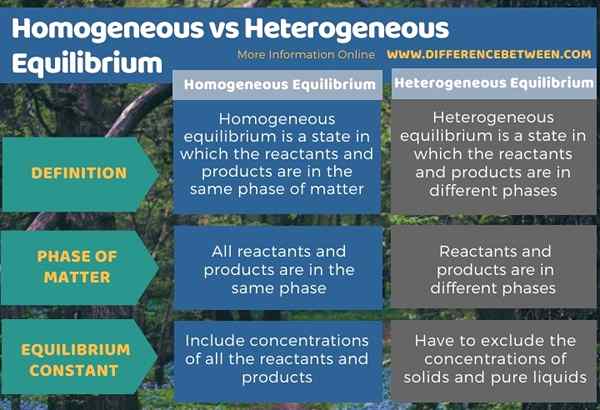
Zusammenfassung -homogener VS. Heterogenes Gleichgewicht
Gleichgewicht ist ein Zustand, in dem die Konzentrationen von Reaktanten und Produkten konstant bleiben. Es gibt zwei Arten von Gleichgewichten als homogenes Gleichgewicht und heterogenes Gleichgewicht. Der Schlüsselunterschied zwischen homogenem und heterogenem Gleichgewicht besteht darin. Darüber hinaus umfasst die Gleichgewichtskonstante für homogene Gleichgewichte Konzentrationen aller Reaktanten und Produkte, während die Gleichgewichtskonstante für heterogene Gleichgewichte die Konzentrationen von Festkörpern und reinen Flüssigkeiten ausschließen muss.
Referenz:
1."Was sind homogene und heterogene Gleichgewichtsreaktionen". Lernen.com, studieren.com, hier erhältlich.
2."15.4: Heterogene Gleichgewichte.”Chemistry Libretexten, Libretexte, 18. September. 2019, hier erhältlich.
3. „Homogen gegen heterogene Lösungsgleichgewichte.”Grenzlose Biologie. Lumen, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Mischungen und reine Substanzen 2 × 2" von John Trombley - eigene Arbeit (CC von 4.0) über Commons Wikimedia


