Unterschied zwischen homolytischer und heterolytischer Bindungsdissoziationsenergie
Schlüsselunterschied - homolytische und heterolytische Bindungsdissoziationsenergie
Bindungsdissoziationsenergie ist ein Maß für die Stärke einer chemischen Bindung. Eine Bindung kann homolytisch oder heterolytisch dissoziiert werden. Bindungsdissoziationsenergie wird definiert als die Standardänderung der Enthalpie, wenn eine chemische Bindung durch Homolyse gespalten wird. Homolytische Bindungsdissoziationsenergie ist die Energiemenge. Der Wert der homolytischen Bindungsdissoziationsenergie unterscheidet sich von dem der heterolytischen Bindungsdissoziationsenergie für dieselbe Verbindung. Dies ist der Schlüsselunterschied zwischen homolytischer und heterolytischer Bindungsdissoziationsenergie.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist homolytische Bindungsdissoziationsenergie
3. Was ist heterolytische Bindungsdissoziationsenergie
4. Seite für Seitenvergleich - homolytische gegen heterolytische Bindungsdissoziationsenergie in tabellarischer Form
5. Zusammenfassung
Was ist homolytische Bindungsdissoziationsenergie?
Homolytische Bindungsdissoziationsenergie ist die Energiemenge, die erforderlich ist, um eine chemische Bindung durch Hämolyse zu dissoziieren. Hämolyse einer chemischen Bindung ist die symmetrische Spaltung der Bindung, die zwei Radikale bildet, nicht zwei Ionen. Hier werden die Bindungselektronen zwischen den Atomen in zwei Hälften unterteilt und von den beiden Atomen genommen. Zum Beispiel bildet die homolytische Spaltung einer Sigma -Bindung zwei Radikale mit einem ungepaarten Elektron pro Radikal.

Abbildung 1: Homolyse
Die Bindungsdissoziationsenergie ist definiert als die Energiemenge, die erforderlich ist, um eine chemische Bindung durch Hämolyse unter Standardbedingungen zu spalten. Die homolytische Bindungsdissoziationsenergie bestimmt, ob eine chemische Bindung stark oder schwach ist. Wenn der Wert der Dissoziationsenergie der homolytischen Bindung höher ist, zeigt er an, dass eine hohe Energiemenge bereitgestellt werden sollte, um diese Bindung zu spalten; Daher ist es eine starke Bindung.
Was ist heterolytische Bindungsdissoziationsenergie?
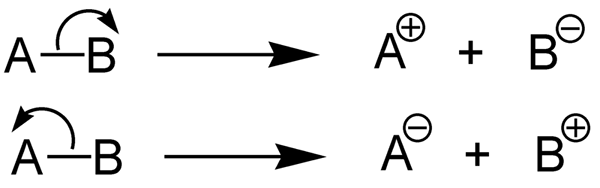
Heterolytische Bindungsdissoziationsenergie ist die Energiemenge, die zur Klave einer chemischen Bindung durch Heterolyse erforderlich ist. Heterolyse ist die Spaltung einer chemischen Bindung auf asymmetrische Weise. Heterolyse bildet Kationen und Anionen. Dies liegt daran, dass in der Heterolyse das Bindungselektronenpaar vom elektronegativen Atom (es wird in das Anion umgewandelt wird) aufgenommen, während das andere Atom keine Elektronen (es bildet das Kation).

Abbildung 2: Heterolyse chemischer Bindungen
Im Vergleich zur Homolyse eines Moleküls ist die Heterolyse desselben Moleküls ein anderer Wert als der der Homolyse. Dies bedeutet, dass die homolytische Bindungsdissoziationsenergie einer Verbindung sich von der heterolytischen Bindungsdissoziationsenergie desselben Moleküls unterscheidet.
Beispiel: Betrachten wir die Spaltung der H-H-Bindung im Wasserstoffmolekül.
Homolytische Bindungsdissoziation: H2 → H ● +H ● (Bindungsdissoziationsenergie beträgt 104 kcal/mol)
Heterolytische Bindungsdissoziation: H2 → h+ + H- (Bindungsdissoziationsenergie beträgt 66 kcal/mol)
Was ist der Unterschied zwischen homolytischer und heterolytischer Bindungsdissoziationsenergie?
Homolytische vs. heterolytische Bindungsdissoziationsenergie | |
| Homolytische Bindungsdissoziationsenergie ist die Energiemenge, die erforderlich ist, um eine chemische Bindung durch Hämolyse zu dissoziieren. | Heterolytische Bindungsdissoziationsenergie ist die Energiemenge, die zur Klave einer chemischen Bindung durch Heterolyse erforderlich ist. |
| Produkt | |
| Homolytische Bindungsdissoziationsenergie ist mit der Bildung von Radikalen durch die Spaltung chemischer Bindungen verbunden. | Heterolytische Bindungsdissoziationsenergie ist mit der Bildung von Kationen und Anionen durch die Spaltung chemischer Bindungen verbunden. |
Zusammenfassung -homolytische gegen heterolytische Bindungsdissoziationsenergie
Bindungsdissoziationsenergie ist die Energie, die erforderlich ist, um eine chemische Bindung durch Homolyse unter Standardbedingungen zu spalten. Es gibt zwei Arten von Bindungsspaltungen als Homolyse und Heterolyse. Die homolytische Bindungsspaltung bildet Radikale, während heterolytische Bindungsspaltung Kationen und Anionen bildet. Der Schlüsselunterschied zwischen homolytischer und heterolytischer Bindungsdissoziationsenergie besteht darin, dass sich der Wert der homolytischen Bindungsdissoziationsenergie von der der heterolytischen Bindungsdissoziationsenergie für dieselbe Verbindung unterscheidet.
Referenz:
1. „Bindungsdissoziationsenergie.”Wikipedia, Wikimedia Foundation, 28. Februar. 2018, hier erhältlich.
2. „Heterolyse (Chemie).”Wikipedia, Wikimedia Foundation, 19. Februar. 2018, hier erhältlich.
3. „Bindungsdissoziationsenergien = homolytische Spaltung.”Master Organic Chemistry RSS, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Homolyse (Chemie)" von Jürgen Martens - Jürgen Martens (Public Domain) über Commons Wikimedia
2. "Heterolyse (Chemie)" von [Jürgen Martens - Jürgen Martens (CC BY -SA 3).0) über Commons Wikimedia


