Unterschied zwischen hydratisiertem Salz und wasserfreiem Salz

Der Schlüsselunterschied zwischen hydratisiertem Salz und wasserfreiem Salz ist, dass die hydratisierte Salzmoleküle werden an Wassermolekülen befestigt, während die wasserfreien Salzmoleküle nicht an Wassermoleküle befestigt sind. Wenn wir hydratisierte Salze erhitzen, emittieren sie Wassermoleküle als Wasserdampf.
Salze sind Verbindungen, die Anionen und Kationen in einer kristallinen Form enthalten. Ein Salz bildet sich aus der Kombination des Anion eines Säure und dem Kation einer Base. Es gibt zwei Salzeformen als hydratisierte Salze und wasserfreie Salze. Diese Verbindungen unterscheiden sich je nach Vorhandensein oder Fehlen von Wassermolekülen. Wir nennen diese Wassermoleküle "Wasser der Kristallisation".
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist hydratisiertes Salz
3. Was ist wasserfreies Salz
4. Seite an Seite Vergleich - hydratisiertes Salz gegen wasserfreies Salz in tabellarischer Form
5. Zusammenfassung
Was ist hydratisiertes Salz?
Hydratisierte Salze sind Salzverbindungen mit Wassermolekülen, die an den Salzmolekülen gebunden sind. Eine bestimmte Salzverbindung enthält eine bestimmte Anzahl von Wassermolekülen. Wir nennen diese Moleküle „Wasser der Kristallisation“, da diese Salzverbindungen Wassermoleküle aufweisen. Diese Wassermoleküle binden chemisch mit den Salzmolekülen. Diese Wassermoleküle verursachen die Form der Kristalle.

Abbildung 01: hydratisiertes Kupfersulfat
Diese hydratisierten Salze bilden sich, wenn ionische Feststoffe aus wässrigen Lösungen kristallisieren. Wenn wir dieses Wasser aus den Salzkristallen entfernen, wird es wasserfrei. Ein häufiges Beispiel für ein Hydrate -Salz ist Kupfersulfat -Pentahydrat (CUSO4.5H2Ö). Wenn wir diese Verbindung erhitzen, wandelt sie daher in wasserfreies Kupfersulfat um. Das liegt daran, dass die Wassermoleküle beim Erhitzen verdampfen.
Was ist wasserfreies Salz?
Wassere Salze sind Verbindungen, die keine Wassermoleküle haben, die an den Salzmolekülen gebunden sind. Wir verwenden diesen Begriff hauptsächlich, wenn das Kristallisationswasser aus hydratisierten Salzen entfernt wird. Daher bezieht sich der Begriff wasserfrei auf ein Trockensalz.

Abbildung 02: Das wasserfreie Kupfersulfat verwandelt sich bei hydratisiert in blaue Farbe
Zum Beispiel ist wasserfreies Natriumsulfat frei von Wasser. Daher können wir es als Trocknungsmaterial verwenden, weil es Wasser aufnehmen und in die hydratisierte Form umwandelt.
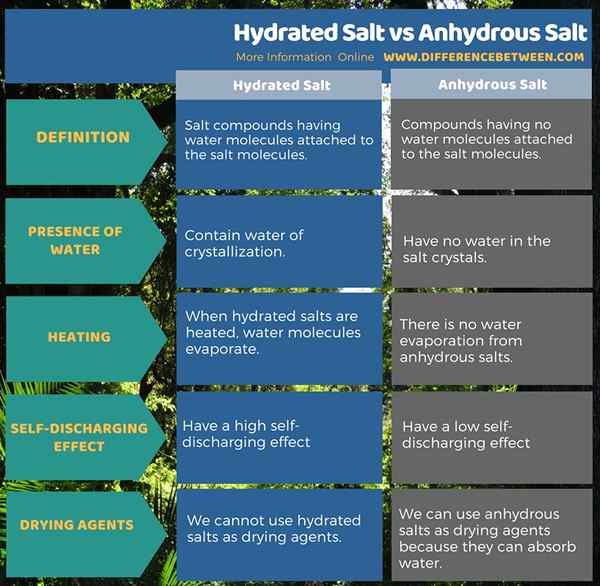
Was ist der Unterschied zwischen hydratisiertem Salz und wasserfreiem Salz?
Hydratisierte Salze sind Salzverbindungen mit Wassermolekülen, die an den Salzmolekülen gebunden sind. Diese Verbindungen enthalten Kristallisationswasser. Wenn wir diese Verbindungen erhitzen, emittieren sie Wassermoleküle als Wasserdampf. Wassere Salze sind Verbindungen, die keine Wassermoleküle haben, die an den Salzmolekülen gebunden sind. Diese Verbindungen haben keine Wassermoleküle in den Salzkristallen.
Zusammenfassung -hydratisiertes Salz gegen wasserfreies Salz
Salz sind Derivate einer Kombination von Säuren und Basen. Es gibt zwei Salzeformen als hydratisierte Salze und wasserfreie Salze. Der Unterschied zwischen hydratisiertem Salz und wasserfreiem Salz besteht darin.
Referenz:
1. „Hydratisierte Salze.”Transport von Mineralien in Pflanzen. Hier verfügbar
2. Helmenstine, Anne Marie, ph.D. „Wasserdreide Definition.”Thoughtco, Jun. 13, 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.'Síran Měěnatý'By Ondřej Manggl - eigene Arbeit, (gemeinfrei) über Commons Wikimedia
2.'Feuchtigkeitscoper (ii) -sulfat'by Benjah-BMM27-eigene Arbeit, (Public Domain) über Commons Wikimedia


