Unterschied zwischen Wasserstoffbindung und Ionenbindung
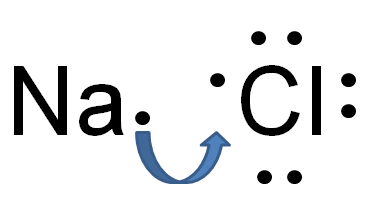
Der Schlüsselunterschied zwischen Wasserstoffbrückenbindung und ionischer Bindung ist Diese ionische Bindung besteht zwischen permanenten Anionen und Kationen, während Wasserstoffbrückenbindungen zwischen teilweise positiven und teilweise negativ.
Chemische Bindungen halten Atome und Moleküle zusammen. Bindungen sind wichtig für die Bestimmung des chemischen und physikalischen Verhaltens von Molekülen und Atomen. Wie vom amerikanischen Chemiker G vorgeschlagen.N.Lewis, Atome sind stabil, wenn sie acht Elektronen in ihrer Valenzschale enthalten. Die meisten Atome haben weniger als acht Elektronen in ihren Valenzschalen (mit Ausnahme der edlen Gase in der Gruppe 18 des Periodenzüchtertabels); Daher sind sie nicht stabil. Diese Atome reagieren dazu, miteinander zu reagieren, um stabil zu werden. Somit kann jedes Atom eine edle -gas elektronische Konfiguration erreichen. Ionenbindungen sind eine solche chemische Bindung, die Atome in chemischen Verbindungen verbindet. Wasserstoffbrückenbindungen sind intermolekulare Attraktionen zwischen Molekülen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Wasserstoffbindung
3. Was ist eine ionische Bindung?
4. Seite an Seitenvergleich - Wasserstoffbrückenbindung gegen ionische Bindung in tabellarischer Form
5. Zusammenfassung
Was ist Wasserstoffbindung?
Wenn Wasserstoff an ein elektronegatives Atom wie Fluor, Sauerstoff oder Stickstoff gebunden ist, erzeugt es eine polare Bindung. Aufgrund der Elektronegativität werden die Elektronen in der Bindung mehr vom elektronegativen Atom als auf das Wasserstoffatom angezogen. Daher erhält das Wasserstoffatom eine teilweise positive Ladung, während das elektronegativere Atom eine teilweise negative Ladung erhält. Wenn zwei Moleküle mit dieser Ladung getrennt sind, steigt eine Anziehungskraft zwischen Wasserstoff und dem negativ geladenen Atom. Wir nennen diese Wasserstoffbindung.
Wasserstoffbrückenbindungen sind relativ stärker als andere Dipolwechselwirkungen und bestimmen das molekulare Verhalten. Zum Beispiel haben Wassermoleküle eine intermolekulare Wasserstoffbrückenbindung. Ein Wassermolekül kann vier Wasserstoffbrückenbindungen mit einem anderen Wassermolekül bilden. Da Sauerstoff zwei einsame Paare hat, kann er zwei Wasserstoffbrückenbindungen mit positiv geladenen Wasserstoff bilden. Dann können wir die beiden Wassermoleküle als Dimer anrufen. Jedes Wassermolekül kann aufgrund der Wasserstoffbrückenbindungsfähigkeit mit vier anderen Molekülen binden. Dies führt zu einem höheren Siedepunkt für Wasser, obwohl ein Wassermolekül ein geringes Molekulargewicht aufweist. Daher ist die Energie, die erforderlich ist, um die Wasserstoffbrückenbindungen zu brechen, wenn sie in die gasförmige Phase gehen.
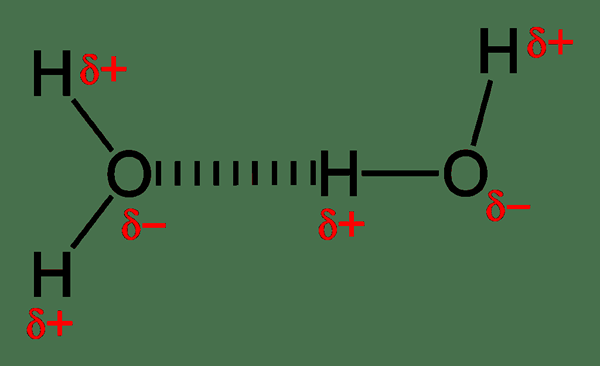
Abbildung 01: Wasserstoffbrückenbindungen zwischen Wassermolekülen
Darüber hinaus bestimmen Wasserstoffbrückenbindungen die Kristallstruktur von Eis. Die einzigartige Anordnung von Eisgitter hilft ihm, auf Wasser zu schweben. Daher schützen Sie das Wasserleben in der Winterperiode. Abgesehen davon spielt die Wasserstoffbindung eine wichtige Rolle in biologischen Systemen. Die dreidimensionale Struktur von Proteinen und DNA basiert ausschließlich auf Wasserstoffbrückenbindungen. Darüber hinaus können Wasserstoffbrückenbindungen durch Heizen und mechanische Kräfte zerstört werden.
Was ist eine ionische Bindung??
Atome können Elektronen gewinnen oder verlieren und negative bzw. positive geladene Partikel bilden. Diese Partikel werden als Ionen bezeichnet. Es gibt elektrostatische Wechselwirkungen zwischen den Ionen. Die ionische Bindung ist die attraktive Kraft zwischen diesen entgegengesetzt geladenen Ionen. Die Stärke der elektrostatischen Wechselwirkungen wird weitgehend von den Elektronegativitätswerten der Atome in einer ionischen Bindung beeinflusst. Elektronegativität ergibt eine Messung der Atome -Affinität zu Elektronen. Ein Atom mit hoher Elektronegativität kann Elektronen aus einem Atom mit geringer Elektronegativität anziehen, um eine ionische Bindung zu bilden.
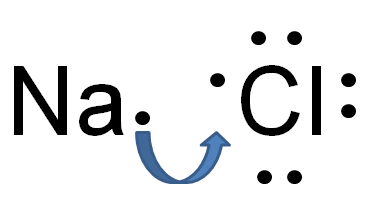
Abbildung 02: Bildung der Ionenbindung in Natriumchlorid
Zum Beispiel hat Natriumchlorid eine ionische Bindung zwischen Natriumion und Chloridion. Natrium ist ein Metall; Daher hat es eine sehr niedrige Elektronegativität (0.9) im Vergleich zu Chlor (3.0). Aufgrund dieses Elektronegativitätsunterschieds kann Chlor ein Elektron aus Natrium anziehen und Cl- und Na+ -Ionen bilden. Aus diesem Grund gewinnen beide Atome die stabile, edel -gas elektronische Konfiguration. Cl- und Na+ werden durch sehr starke attraktive elektrostatische Kräfte zusammengehalten und so eine ionische Bindung bilden.
Was ist der Unterschied zwischen Wasserstoffbindung und ionischer Bindung?
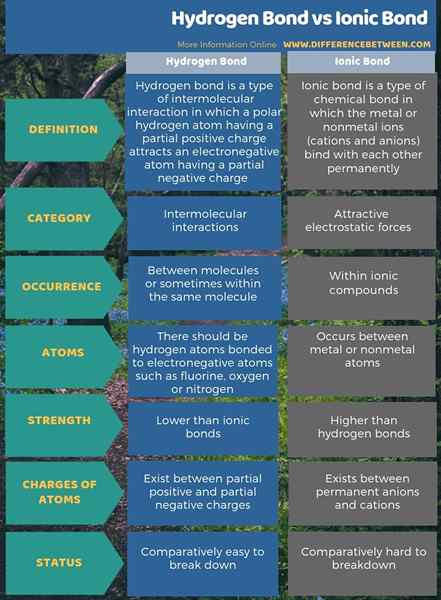
Wasserstoffbrückenbindungen sind intermolekulare Attraktionen, während ionische Bindungen attraktive elektrostatische Kräfte sind. Der Schlüsselunterschied zwischen Wasserstoffbindung und ionischer Bindung besteht darin, dass die ionische Bindung zwischen permanenten Anionen und Kationen besteht. Darüber hinaus sind ionische Bindungen stärker als Wasserstoffbrückenbindungen.
Darüber hinaus treten Wasserstoffbrückenbindungen auf, wenn ein Wasserstoffatom und ein elektronegatives Atom vorhanden sind. Dies ist also ein signifikanter Unterschied zwischen Wasserstoffbrückenbindung und ionischer Bindung. Außerdem besteht ein weiterer Unterschied zwischen Wasserstoffbrückenbindung und ionischer Bindung darin, dass die Wasserstoffbrückenbindungen leicht zu brechen sind.
Zusammenfassung -Wasserstoffbindung und Ionenbindung
Ionenbindungen treten innerhalb ionischer Verbindungen auf. Wasserstoffbrückenbindungen sind intermolekulare Bindungen. Der Schlüsselunterschied zwischen Wasserstoffbindung und ionischer Bindung besteht darin, dass die ionische Bindung zwischen permanenten Anionen und Kationen besteht.
Referenz:
1. Helmenstine, Anne Marie. „Wasserstoffbrückenbindungsdefinition und Beispiele.Denkweise Mai. 6, 2019, hier erhältlich.
2. Helmenstine, Anne Marie. „Ionenbindungsdefinition.”Thoughtco, Jan. 26, 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Wasserstoffbrückenbindungen-in-Wasser-2D" (Public Domain) über Commons Wikimedia
2. "NaCl Ionic Bond" von Mhowison - eigene Arbeit (öffentlich zugänglich) über Commons Wikimedia


