Unterschied zwischen Hydrolyse und Kondensation

Hydrolyse gegen Kondensation
Kondensation und Hydrolyse sind zwei Arten von chemischen Reaktionen, die an der Bildung von Bindungen und dem Bindungsbruch beteiligt sind. Kondensation ist das Umkehr der Hydrolyse. Diese beiden Arten von Reaktionen werden häufig in biologischen Systemen gefunden, und wir verwenden diese Reaktionen auch, um viele wirtschaftlich wichtige Produkte zu erhalten.
Kondensation
Kondensationsreaktionen sind eine Art chemischer Reaktion, bei der kleine Moleküle zusammenkommen, um ein großes einzelnes Molekül zu bilden. Die Reaktion findet innerhalb von zwei funktionellen Gruppen in den Molekülen statt. Andere charakteristische Merkmale einer Kondensationsreaktion ist, dass während der Reaktion ein kleines Molekül verloren geht. Dieses Molekül kann Wasser, Wasserstoffchlorid, Essigsäure usw. sein. Wenn das verlorene Molekül Wasser ist, werden diese Arten von Kondensationsreaktionen als Dehydrationsreaktionen bezeichnet. Da die Reaktantenmoleküle kleiner sind und das Produktmolekül sehr groß ist, ist die Produktdichte immer höher als die Reaktionen bei Kondensationsreaktionen. Kondensationsreaktionen finden auf verschiedene Weise statt. Zum Beispiel können wir diese in zwei Arten als intermolekulare Kondensationsreaktionen und intra-molekulare Kondensationsreaktionen unterteilt. Wenn sich die beiden funktionellen Gruppen im selben Molekül befinden, werden sie als intra-molekulare Kondensationen bezeichnet. Zum Beispiel hat Glucose eine lineare Struktur wie folgt.
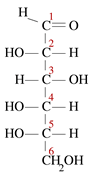
In einer Lösung befindet sich die Mehrheit der Moleküle in einer zyklischen Struktur. Wenn sich eine zyklische Struktur bildet, wird der -OH auf Kohlenstoff 5 in die Etherbindung umgewandelt, um den Ring mit Carbon 1 zu schließen. Dies bildet eine Hemiacetal -Ringstruktur von sechs Mitglieds. Während dieser intra-molekularen Kondensationsreaktion wird ein Wassermolekül abgewehrt und eine Etherverknüpfung gebildet. Intermolekulare Reaktionen produzieren viele nützliche und gemeinsame Produkte. Währenddessen findet die Reaktion zwischen den funktionellen Gruppen von zwei getrennten Molekülen statt. Zum Beispiel sind Aminosäuren bei der Bildung eines Makromoleküls wie Protein kondensiert. Es wird ein Wassermolekül freigesetzt, und eine Amidverknüpfung wird gebildet, die als Peptidbindung bekannt ist. Wenn zwei Aminosäuren zusammengebunden sind, wird ein Dipeptid gebildet, und wenn viele Aminosäuren verbunden sind, wird es als Polypeptid bezeichnet. DNA und RNA sind auch zwei Makromoleküle, die infolge von Kondensationsreaktionen zwischen Nukleotiden gebildet werden. Kondensationsreaktionen produzieren sehr große Moleküle und manchmal sind die Moleküle nicht so groß. Zum Beispiel: Bei der Veresterungsreaktion zwischen einem Alkohol und einer Carbonsäure, einem kleinen Estermolekül, wenn er gebildet wird. Kondensation ist wichtig bei der Polymerbildung. Polymere sind große Moleküle, die immer wieder die gleiche Struktureinheit haben, die sich immer wieder wiederholt. Die sich wiederholenden Einheiten werden Monomere genannt. Diese Monomere sind mit kovalenten Bindungen miteinander verbunden, um ein Polymer zu bilden.
Hydrolyse
Dies ist eine Reaktion, bei der eine chemische Bindung unter Verwendung eines Wassermoleküls gebrochen wird. Während dieser Reaktion wird ein Wassermolekül in ein Proton und ein Hydroxidion aufgeteilt. Und dann werden diese beiden Ionen zu den beiden Teilen des Moleküls hinzugefügt, in denen die Bindung gebrochen ist. Zum Beispiel finden Sie ein Ester. Die Esterbindung ist zwischen -co und -o.
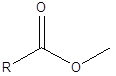
In der Hydrolyse trägt das Proton aus dem Wasser zur -o -Seite, und das Hydroxid -Ion fügt die -co -Seite hinzu. Daher bilden sich aufgrund der Hydrolyse ein Alkohol und eine Carboxsäure, die bei der Bildung des Esters die Reaktanten waren.
| Was ist der Unterschied zwischen Hydrolyse und Kondensation? • Die Hydrolyse ist das Gegenteil der Kondensation. • Kondensationsreaktionen machen chemische Bindungen, während die Hydrolyse chemische Bindungen durchbricht. • Polymere werden durch Kondensationsreaktionen gemacht und durch Hydrolysereaktionen gebrochen. • Bei Kondensationsreaktionen kann Wassermolekül freigesetzt werden. In den Hydrolysereaktionen wird Wassermolekül in das Molekül eingebaut. |


