Unterschied zwischen Iodometrie und Iodimetrie

Der Schlüsselunterschied Zwischen Iodometrie und Jodimetrie ist das Wir können Iodometrie verwenden, um Oxidationsmittel zu quantifizieren, während wir mit Iodimetrie die Reduktionsmittel quantifizieren können.
Iodometrie und Iodimetrie sind zwei häufige Titrationsmethoden, die in der analytischen Chemie nützlich sind. Die Grundlage dieser beiden Arten von Titrationen ist die Oxidationsreduktion, und wir können sie verwenden, um Redoxspezies quantitativ zu bestimmen. Die Grundlage der Titration ist eine Reaktion zwischen dem Analyten und einem Standardreagenz, das als Titrant bezeichnet wird. Wir können die Menge des Analyten bestimmen, wenn wir die Reaktion, die Stöchiometrie und das Volumen/die Masse des Titrants kennen. Darüber hinaus können wir Jod für diese Redox -Titrationen verwenden, da wir mit vielen Arten schnell reagieren können. Reversibilität von Iodin/Iodid, die Reaktion ist auch ein Vorteil, wenn sie in iodometrischen Reaktionen verwendet werden.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Iodometrie?
3. Was ist Iodimetrie?
4. Seite für Seitenvergleich - Iodometrie gegen Iodimetrie in tabellarischer Form
5. Zusammenfassung
Was ist Iodometrie??
In Iodometrie reagieren Iodide mit einem anderen Oxidationsmittel in einem sauren Medium oder neutralem Medium. Wenn diese Reaktion stattfindet, oxidiert Jodid (wir fügen Jodid in Form von KI) zu Jod zu oxidieren, und die anderen Spezies wird durch Jodid reduziert. Dann können wir das freigesetzte Jod mit einer anderen Art titrieren. Diese titrierende Spezies ist eine Standardlösung eines Reduktionsmittels, das Jod zurück in die Iodidform reduzieren kann. Normalerweise verwenden wir dafür eine Standard -Thiosulfatlösung. Wenn wir beispielsweise die in einer Mischung gelöste Chlormenge quantifizieren möchten, ist Folgendes die Methode zur Durchführung einer iodometrischen Titration.
Zunächst sollten wir ein bekanntes Volumen aus der Mischung (in dem sich Chlor gelöst) in einen Titrationskolben einnehmen. Dann können wir es mit einer bekannten Lösung von KI titrieren und das Volumen konsumiert finden.
Nach der Redox -Reaktion findet im Reaktionsflaschen statt
Cl2 + 2i- -> 2 Cl- + ICH2

Abbildung 01: Die Farbänderung der Iodometrie
Dann sollten wir eine weitere Titration mit derselben Mischung durchführen, um die freigesetzte Menge an Jod zu bestimmen. Dafür können wir die Mischung mit einer Standard -Thiosulfatlösung titrieren. Wir müssen Stärke als Indikator hinzufügen, um den Endpunkt dieser Reaktion zu bestimmen. Mit Jod und Stärke in der Mischung erscheint es in dunkelblau-Farbe, aber am Endpunkt, wenn das gesamte Jod fertig ist, verschwindet die dunkle Farbe.
ICH2 + 2 s2Ö32– → s4Ö62– + 2 i-
Aus den beiden oben genannten Titrationen können wir die Menge an CL bestimmen2.
Was ist Iodimetrie??
In der Iodimetrie verwendet es kostenlose Jod, um sich mit einem Reduktionsmittel Titration zu unterziehen. Daher reduziert sich Jod auf Iodid, und Jod wird andere Spezies oxidieren.

Abbildung 02: Durchführen einer Titration
Da wir eine kostenlose Jodlösung nicht einfach vorbereiten können, müssen wir Jod mit Kaliumjodid und Ki mischen3 Lösung zur Herstellung der erforderlichen Lösung. Und eine Standardlösung davon wird für die iodometrischen Titrationen verwendet.
Ki+i2 → ki3
Die folgende Reaktion erfolgt beim Titrieren. Wir können Stärke als Indikator auch für iodometrische Titrationen verwenden.
ICH2 + Reduktionsagent → 2 i-
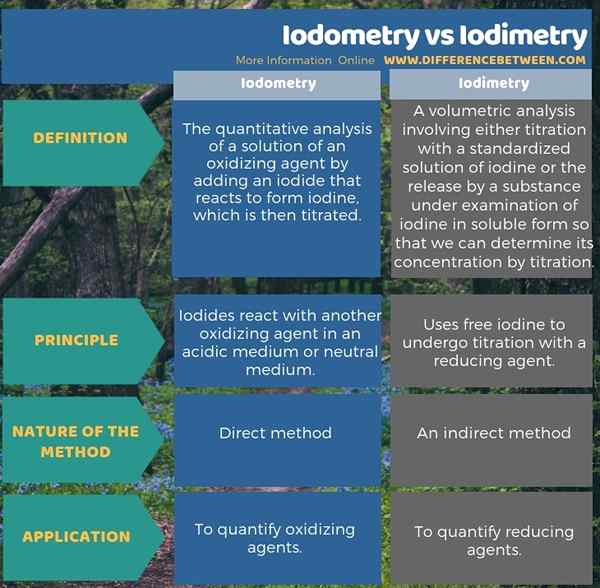
Was ist der Unterschied zwischen Iodometrie und Iodimetrie?
Iodometrie ist die quantitative Analyse einer Lösung eines Oxidationsmittels durch Zugabe eines Jodids, das auf Jod bildet, das dann titriert wird, während Iodimetrie eine volumetrische Analyse ist, die entweder Titration mit einer standardisierten Lösung von Iodin oder der Freisetzung durch einen untersuchten Substanz beinhaltet von Jod in löslicher Form, damit wir seine Konzentration durch Titration bestimmen können. Dies ist ein Unterschied zwischen Iodometrie und Iodimetrie.
Ein weiterer Unterschied zwischen Iodometrie und Iodimetrie besteht darin, dass Iodide in Iodometrie in einem sauren Medium oder neutralem Medium in Iodimetrie mit einem anderen oxidierenden Mittel reagieren. Sie verwendet freie Jod, um sich mit einem Reduktionsmittel Titration zu unterziehen.
Die folgende Infografik zeigt den Unterschied zwischen Iodometrie und Iodimetrie in tabellarischer Form.
Zusammenfassung -Iodometrie gegen Iodimetrie
Obwohl die beiden Begriffe Iodometrie und Iodimetrie ähnlich klingen, sind sie zwei verschiedene Techniken, die wir in der analytischen Chemie verwenden. Der Schlüsselunterschied zwischen Iodometrie und Iodimetrie besteht darin, dass wir Iodometrie verwenden können, um Oxidationsmittel zu quantifizieren, während wir Iodimetrie verwenden können, um die Reduktionsmittel zu quantifizieren.
Referenz:
1. „Iodometrie.Wikipedia, Wikimedia Foundation, 9. September. 2018. Hier verfügbar
2. Naviglio, Daniele. "Iodometrie und Iodimetrie, Daniele Naviglio" Analytische Chemie "Agraria" Federica E-Learning.Federica, Federica Web Learning, Universität di Napoli Federico II, 20. März. 2012. Hier verfügbar
Bild mit freundlicher Genehmigung:
1."Iodometrische Titrationsmischung" von Lhchem - eigene Arbeit, (CC BY -SA 3.0) über Commons Wikimedia
2."Schulebene Titration Demonstration" von UCL - Flickr (CC von 2 ".0) über Commons Wikimedia


