Unterschied zwischen Isophthalsäure und Terephthalsäure
Der Schlüsselunterschied zwischen Isophthalsäure und Terephthalsäure ist das Isophthalsäure hat ihre zwei Carboxsäuregruppen von einem Kohlenstoffatom getrennt. Terephthalsäure hat ihre zwei Carboxylsäuregruppen von zwei Kohlenstoffatomen getrennt.
Isophthalsäure und Terephthalsäure sind wichtige organische Verbindungen, die aromatische Carboxsäuren sind, die zwei CooH -Gruppen pro Molekül enthalten.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Isophthalsäure
3. Was ist Terephthalsäure
4. Seite an Seite Vergleich - Isophthalsäure gegen Terephthalsäure in tabellarischer Form
5. Zusammenfassung
Was ist Isophthalsäure?
Isophthalsäure ist eine aromatische organische Verbindung mit der chemischen Formel C6H4(Co2H)2 und Meta -Konformation. Die Molmasse dieser Verbindung beträgt 166 g/mol. Außerdem tritt es als farblose feste Verbindung auf. Isophthalsäure ist ein Isomer aus Phthalsäure und Terephthalsäure.
Bei der Betrachtung des Produktionsprozesses können wir Isophthalsäure durch oxidierende Meta-Xylol in Gegenwart von Sauerstoff produzieren. Dies ist ein Produktionsprozess im Industriemaßstab. Dieser Prozess erfordert auch einen Katalysator wie Cobalt-Mangankatalysator. Wir können jedoch durch Fusion von Kalium-Meta-Sulfobenzoat mit Kaliumformiat in Gegenwart von Chromsäure Isophthalsäure produzieren.
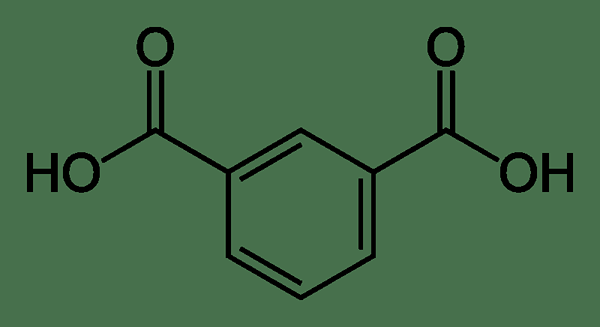
Darüber hinaus ist Isophthalsäure eine aromatische Verbindung. Und es besteht aus einem Benzolring mit zwei Carboxylsäuregruppen, die zum Ring ersetzt werden. Hier befindet sich eine Carboxylsäure -Gruppe im Vergleich zu der anderen Carbonsäurgruppe in der Meta -Position. Daher sind die beiden funktionellen Gruppen von einem Kohlenstoffatom des Rings voneinander getrennt.

Abbildung 01: Die chemische Struktur von Isophthalsäure
Außerdem ist Isophthalsäure in Wasser unlöslich. Die Hauptverwendung dieser Verbindung besteht in der Herstellung von PET- oder Polyethylen -Terephthalatpolymermaterial, das als Harz nützlich ist. Darüber hinaus können wir es zur Herstellung von ungesättigtem Polyesterharz oder UPR verwenden.
Was ist Terephthalsäure?
Terephthalsäure ist eine aromatische organische Verbindung mit der chemischen Formel C6H4(Co2H)2 und Para -Konformation. Es tritt als weißes kristallines Pulver auf. Außerdem ist es in Wasser unlöslich, aber in polaren organischen Lösungsmitteln löslich.
Bei der Betrachtung der Produktion von Terephthalsäure ist der Hauptprozess der Amoco -Prozess. Hier wird die Säure durch Oxidation von p-xylen in Gegenwart von Sauerstoff in der Luft erzeugt. Die Reaktion ist wie folgt:
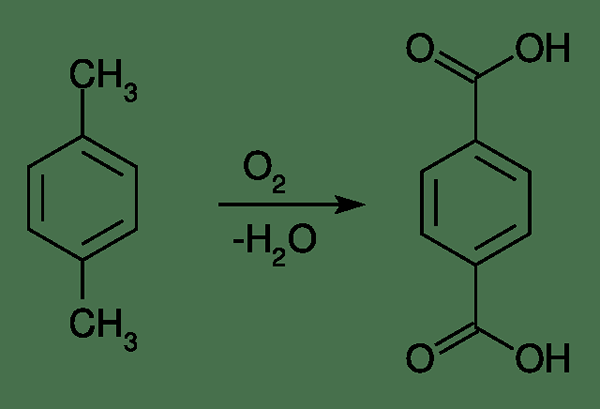
Abbildung 02: Der Produktionsprozess von Terephthalsäure
Außerdem gibt es in Bezug auf die Anwendungen viele Verwendungen von Terephthalsäure. Zum Beispiel ist es als Vorläufer für die PET -Produktion (Polyethylen -Terephthalat) nützlich, die in Farben als Trägerverbindung als Rohstoff für bestimmte Arzneimittel in pharmazeutischen Anwendungen verwendet werden, als Füllstoff in bestimmten militärischen Rauchgranaten usw.
Was ist der Unterschied zwischen Isophthalsäure und Terephthalsäure?
Der Schlüsselunterschied zwischen Isophthalsäure und Terephthalsäure besteht darin. Terephthalsäure hat ihre zwei Carboxylsäuregruppen von zwei Kohlenstoffatomen getrennt. Darüber hinaus ist Isophthalsäure eine aromatische organische Verbindung mit der chemischen Formel C6H4(Co2H)2 und Metakonformation, während Terephthalsäure eine aromatische organische Verbindung mit der chemischen Formel C ist6H4(Co2H)2 und Para -Konformation.
Die folgende Infografik zeigt eine detailliertere Tabelle des Unterschieds zwischen Isophthalsäure und Terephthalsäure.

Zusammenfassung -Isophthalsäure gegen Terephthalsäure
Isophthalsäure und Terephthalsäure sind wichtige organische Verbindungen, die aromatische Carboxsäuren sind, die zwei CooH -Gruppen pro Molekül enthalten. Der Schlüsselunterschied zwischen Isophthalsäure und Terephthalsäure besteht darin. Terephthalsäure hat jedoch ihre zwei Carboxsäuregruppen von zwei Kohlenstoffatomen getrennt.
Referenz:
1. „Isophthalsäure.Nationales Zentrum für Biotechnologieinformationen. Pubchem Compound -Datenbank, u.S. National Library of Medicine, hier verfügbar.
2. "Terephthalsäure.”Terephthalsäure - Ein Überblick | Sciencedirect -Themen, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Isophthale-Sacid-2D-Skelettal" (Public Domain) über Commons Wikimedia
2. "Oxidation p xylen" von Simon.KR - eigene Arbeit (CC BY -SA 3.0) über Commons Wikimedia


