Unterschied zwischen linearen und gebogenen Molekülen
Der Schlüsselunterschied Zwischen linearen und gebogenen Molekülen ist das Lineare Moleküle haben Atome miteinander gebunden und bilden ein geraftes Molekül.
Die Begriffe lineare Moleküle und gebogene Moleküle beschreiben die Formen verschiedener Moleküle. Abhängig von der Form des Moleküls können wir verschiedene chemische Verbindungen in verschiedene Gruppen kategorisieren. linear, eckig/gebogen, planar, pyramidal usw. usw. Lineare und gebogene Formen sind die einfachsten unter ihnen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind lineare Moleküle
3. Was sind gebogene Moleküle
4. Seite an Seite Vergleich - linear gegen gebogene Moleküle in tabellarischer Form
5. Zusammenfassung
Was sind lineare Moleküle?
Lineare Moleküle sind gerade Moleküle mit einem Bindungswinkel von 180 Grad. Grundsätzlich enthalten diese Moleküle ein zentrales Atom, das über einzelne oder doppelte Bindungen an zwei andere Atome gebunden ist (manchmal kann es auch dreifache Bindungen geben). Die Polarität dieser Art von Molekülen ist Null, wenn die beiden gebundenen Atome identisch sind. Wenn jedoch zwei verschiedene Atome an einem zentralen Atom gebunden sind, das ein lineares Molekül bildet, bildet es eine polare Verbindung. Die Koordinationszahl des zentralen Atoms beträgt zwei, da es zwei gebundene Atome hat.
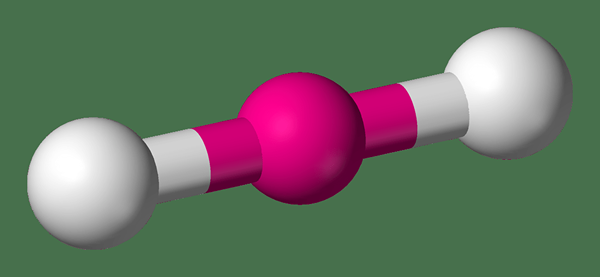
Abbildung 01: Form eines linearen Moleküls
Darüber hinaus hat das zentrale Atom normalerweise entweder keine einzelnen Elektronenpaare oder drei einsame Elektronenpaare. Einige häufige Beispiele für lineare Moleküle sind Kohlendioxid (das zentrale Atom ist Kohlenstoff und zwei Sauerstoffatome werden über Doppelbindungen, die eine unpolare Verbindung bilden Bildung eines linearen Moleküls), Wasserstoffcyanid (enthält ein zentrales Kohlenstoffatom, das über eine einzelne Bindung an ein Wasserstoffatom gebunden ist, und über eine Dreifachbindung an ein Stickstoffatom) usw.
Was sind gebogene Moleküle?
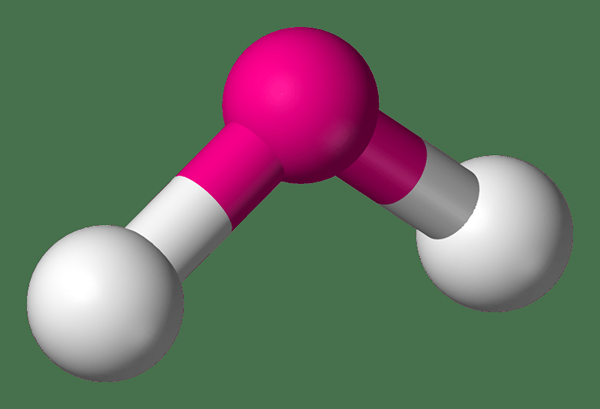
Bogenmoleküle sind Winkelmoleküle mit einem Bindungswinkel, der unter 180 Grad liegt. Dies bedeutet, dass diese Moleküle nichtlineare Moleküle sind. In den meisten Fällen bilden einige Atome wie Sauerstoff aufgrund ihrer Elektronenkonfiguration gebogene Moleküle. Der Bindungswinkel eines gebogenen Molekül.

Abbildung 02: Form eines gebogenen Moleküls
Wir können üblicherweise eine nichtlineare Anordnung von Molekülen in triatomischen Molekülen und Ionen beobachten, die nur Hauptgruppenelemente enthalten. Die gebogene Struktur dieser Moleküle ist ein Ergebnis des Vorhandenseins von einsamen Elektronenpaaren im zentralen Atom. Die häufigsten Beispiele für gebogene Moleküle sind Wasser, Stickstoffdioxid, CH2 usw.
Was ist der Unterschied zwischen linearen und gebogenen Molekülen?
Der Schlüsselunterschied zwischen linearen und gebogenen Molekülen besteht darin, dass lineare Moleküle Atome miteinander gebunden sind und ein geraftes Molekül bilden, während gebogene Moleküle die Atome in einem Biegeform mit einem Winkel angeordnet sind. Darüber hinaus sind lineare Moleküle gerade Moleküle mit einem Bindungswinkel von 180 Grad, während gebogene Moleküle Winkelmoleküle mit einem Bindungswinkel sind, der unter 180 Grad liegt.
Die folgende Infografik fasst den Unterschied zwischen linearen und gebogenen Molekülen zusammen.

Zusammenfassung -linear gegen gebogene Moleküle
Die Form oder Geometrie verschiedener Moleküle kann verwendet werden, um die Moleküle in verschiedene Gruppen zu kategorisieren. Lineare und gebogene Moleküle sind zwei solcher Gruppen von Molekülen. Der Schlüsselunterschied zwischen linearen und gebogenen Molekülen besteht darin, dass lineare Moleküle die Atome miteinander gebunden sind und ein geraft.
Referenz:
1. „Bent molekulare Geometrie.”Wikipedia.org, 30. Mai 2020, hier verfügbar.
Bild mit freundlicher Genehmigung:
1. "Linear-3D-Balls" (Public Domain) über Commons Wikimedia
2. "Bent-3d-Balls" (Public Domain) über Commons Wikimedia


