Unterschied zwischen Lyman und Balmer Serie
Der Schlüsselunterschied Zwischen Lyman und Balmer Series ist das Die Lyman -Serie bildet sich, wenn ein angeregtes Elektron das Energieniveau n = 1 erreicht, während die Balmer -Serie bildet, wenn ein angeregtes Elektron den Energieniveau n = 2 erreicht.
Die Lyman -Serie und die Balmer -Serie sind nach den Wissenschaftlern benannt, die sie gefunden haben. Der Physiker Theodore Lyman entdeckte die Lyman -Serie, während Johann Balmer die Balmer -Serie entdeckte. Dies sind Arten von Wasserstoffspektrallinien. Diese beiden Linienreihen ergeben sich aus Emissionsspektren des Wasserstoffatoms.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist die Lyman -Serie
3. Was ist Balmer -Serie
4. Nebenseitiger Vergleich - Lyman gegen Balmer -Serie in tabellarischer Form
5. Zusammenfassung
Was ist die Lyman -Serie?
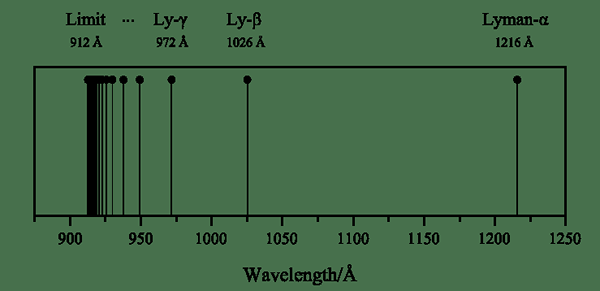
Die Lyman -Serie ist eine Wasserstoffspektrallinienserie, die sich bildet, wenn ein angeregtes Elektron auf das Energieniveau n = 1 kommt. Und dieses Energieniveau ist das niedrigste Energieniveau des Wasserstoffatoms. Die Bildung dieser Linienserie ist auf die ultravioletten Emissionslinien des Wasserstoffatoms zurückzuführen.

Abbildung 01: Lyman -Serie
Darüber hinaus können wir jeden Übergang mit griechischen Buchstaben benennen. Der Übergang eines angeregten Elektrons von n = 2 zu n = 1 ist die Lyman Alpha -Spektrallinie, von n = 3 bis n = 1 ist Lyman Beta und so weiter. Der Physiker Theodore Lyman fand die Lyman -Serie 1906.
Was ist Balmer -Serie?
Die Balmer -Serie ist eine Wasserstoffspektrallinienserie, die sich bildet, wenn ein angeregtes Elektron auf das Energieniveau n = 2 kommt. Darüber hinaus zeigt diese Serie die Spektrallinien für die Emissionen des Wasserstoffatoms und hat mehrere prominente ultraviolette Balmer -Linien mit Wellenlängen, die kürzer als 400 nm sind.

Abbildung 02: Balmer -Serie
Die Balmer -Serie wird unter Verwendung der Balmer -Formel berechnet, einer empirischen Gleichung, die Johann Balmer 1885 entdeckt hat.
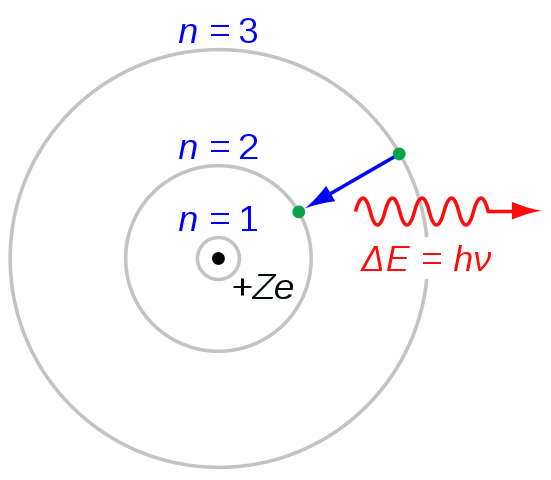
Abbildung 03: Elektronenübergang für die Bildung der Balmer -Serie
Wenn wir jede Zeile in der Serie benennen, verwenden wir den Buchstaben „H“ mit griechischen Buchstaben. Zum Beispiel führt der Übergang von n = 3 zu n = 2 zu der H-Alpha-Linie, von n = 4 zu n = 2 führt zur H-beta-Linie und so weiter. Der Buchstaben „H“ steht für „Wasserstoff“. Bei der Betrachtung der Wellenlängen befindet sich die erste Spektrallinie im sichtbaren Bereich des elektromagnetischen Spektrums. Und diese erste Zeile hat eine leuchtend rote Farbe.
Was ist der Unterschied zwischen Lyman und Balmer Serie?
Lyman- und Balmer -Serien sind Wasserstoffspektrallinienreihen, die aus Wasserstoffemissionsspektren entstehen. Der wichtigste Unterschied zwischen der Lyman- und Balmer -Serie besteht darin, dass sich die Lyman -Serie bildet, wenn ein angeregtes Elektron das Energieniveau n = 1 erreicht, während die Balmer -Serie bildet, wenn ein angeregtes Elektron das Energieniveau n = 2 erreicht. Einige Linien der Schuldverzinsung befinden sich im sichtbaren Bereich des elektromagnetischen Spektrums. Aber die Lyman -Serie ist im UV -Wellenlängenbereich.
Die Lyman -Serie und die Balmer -Serie wurden nach den Wissenschaftlern benannt, die sie gefunden haben. Der Physiker Theodore Lyman fand die Lyman -Serie, während Johann Balmer die Balmer -Serie fand. Wenn wir die Zeilen der Spektren benennen, verwenden wir einen griechischen Buchstaben. Für die Zeilen in der Lyman-Serie sind die Namen als Lyman Alpha, Lyman Beta und so weiter, wohingegen für die Zeilen in der Balmer-Serie die Namen als H-Alpha, H-beta usw. sind.
Die folgende Infografik fasst den Unterschied zwischen Lyman und Balmer -Serie zusammen.

Zusammenfassung -Lyman gegen Balmer -Serie
Lyman- und Balmer -Serien sind Wasserstoffspektrallinienreihen, die sich aus Wasserstoffemissionsspektren ergibt. Der Hauptunterschied zwischen der Lyman- und Balmer -Serie besteht darin, dass sich die Lyman -Serie bildet, wenn ein angeregtes Elektron das Energieniveau n = 1 erreicht, während sich die Balmer -Serie bildet, wenn ein angeregtes Elektron das Energieniveau n = 2 erreicht. Der Physiker Theodore Lyman entdeckte die Lyman -Serie, während Johann Balmer die Balmer -Serie entdeckte.
Referenz:
1. „Balmer -Serie.Wikipedia, Wikimedia Foundation, 21. Oktober. 2019, hier erhältlich.
2. „Lyman -Serie.Wikipedia, Wikimedia Foundation, 7. Oktober. 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Lymanserien" von Lymanseries1.GIF: Original -Uploader war Adriferr bei en.Wikipediaderivative Arbeit: Orangedog (Diskussion • Beiträge) - Lymaneries1.Giftectorisiert vom Original. Präzision reduziert sich auch, um den meisten Quellen zuzustimmen., (CC BY-SA 3.0) über Commons Wikimedia
2. "Sichtbares Spektrum von Wasserstoff" von Jan Homann - eigene Arbeit (CC BY -SA 3.0) über Commons Wikimedia
3. "Bohratommodell" von Jabberwok (CC BY-SA 3.0) über Commons Wikimedia


