Unterschied zwischen Magnesiumchlorid und Magnesiumsulfat

Der Schlüsselunterschied Zwischen Magnesiumchlorid und Magnesiumsulfat ist das Das Magnesiumchloridmolekül hat ein Magnesiumkation, das mit zwei Chloridanionen assoziiert ist, während Magnesiumsulfatmolekül ein Magnesiumkation aufweist, das mit einem Sulfatanion assoziiert ist.
Magnesium ist ein alkalisches Erdmetall, das ein zweiwertiges stabiles Kation bilden kann. Dieses Kation kann viele ionische Verbindungen wie Magnesiumchlorid und Magnesiumsulfat bilden. Beide sind feste Verbindungen bei Raumtemperatur, die in verschiedenen hydratisierten Formen existieren können. In diesem Artikel werden weitere Details zu diesen beiden Verbindungen und anderen Unterschieden zwischen ihnen erörtert.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Magnesiumchlorid
3. Was ist Magnesiumsulfat
4. Seite für Seitenvergleich - Magnesiumchlorid gegen Magnesiumsulfat in tabellarischer Form
5. Zusammenfassung
Was ist Magnesiumchlorid?
Magnesiumchlorid ist eine anorganische Verbindung mit der chemischen Formel MGCL2. Es kann in verschiedenen Hydratformen existieren. Diese Verbindungen sind ionische Halogenide und hoch wasserlöslich. Wir können die hydratisierten Formen aus Meerwasser über verschiedene Extraktionen erhalten. Die Molmasse der wasserfreien Form beträgt 95.211 g/mol. Es ist ein weißer bis farbloser kristalline Feststoff.

Abbildung 01: Magnesiumchloridkristalle
Der Schmelzpunkt ist 714 ° C und der Siedepunkt beträgt 1412 ° C. Die Kristallisation dieser Verbindung ähnelt der Cadmiumchloridkristallisation. Es hat oktaedrische Mg -Zentren. Die häufigsten Hydrate umfassen Magnesiumchlorid, die mit 2, 4, 6, 8 und 12 Wassermolekülen assoziiert sind.
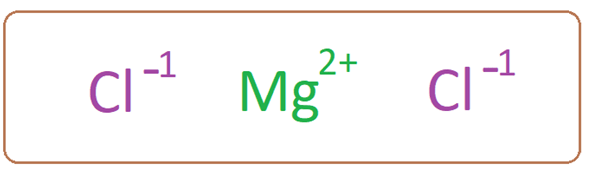
Magnesiumchlorid hat ein Magnesiumkation, das mit zwei Chloridanionen assoziiert ist
Wir können diese Verbindung über Dow -Prozess produzieren, bei dem Magnesiumhydroxid mit HCL -Säure behandelt wird, um Magnesiumchlorid und Wasser zu erhalten.
Mg (OH)2 + HCl → Mgcl2 + H2Ö
Die Anwendungen dieser Verbindung umfassen die Produktion von Magnesiummetall durch Elektrolyse, Staubkontrolle, Bodenstabilisierung, als Katalysatorunterstützung für Ziegler-Natta-Katalysator usw.
Was ist Magnesiumsulfat?
Magnesiumsulfat ist eine anorganische Verbindung mit der chemischen Formel MGSO4. Es ist ein Magnesiumsalz und kann auch in mehreren hydratisierten Formen existieren. Die Molmasse der wasserfreien Form beträgt 120.36 g/mol. Es erscheint bei Raumtemperatur als weißer kristalliner Feststoff. Diese Verbindung ist geruchlos. Es hat keinen Schmelzpunkt. Stattdessen zersetzt es sich bei 1124 ° C.

Abbildung 02: wasserfreies Magnesiumsulfat
Im Gegensatz zu Magnesiumsulfat ist diese Verbindung nicht so viel wasserlöslich. Die hydratisierten Formen umfassen Magnesiumsulfat, die mit 1, 4, 5, 6 und 7 Wassermolekülen assoziiert sind.
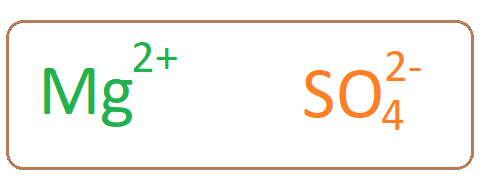
Magnesiumsulfatmolekül hat ein Magnesiumkation, das mit einem Sulfatanion assoziiert ist
Die Anwendungen dieser Verbindung sind im Bereich der Medizin als Mineral für die pharmazeutische Produktion von Magnesium, die Paste dieser Verbindung nützlich bei der Behandlung von Hautentzündungen usw. Darüber hinaus ist es in der Landwirtschaft nützlich, die Niveaus von Magnesium und Schwefel im Boden zu erhöhen.
Was ist der Unterschied zwischen Magnesiumchlorid und Magnesiumsulfat?
In Anbetracht der molekularen Struktur beider weist das Magnesiumchloridmolekül ein Magnesiumkation auf. Dies ist der Schlüsselunterschied zwischen Magnesiumchlorid und Magnesiumsulfat.
Darüber hinaus ist das Magnesiumchlorid eine anorganische Verbindung mit der chemischen Formel MGCL2. Die Molmasse der wasserfreien Form beträgt 95.211 g/mol. Darüber hinaus umfassen die häufigsten Hydrate Magnesiumchlorid, die mit 2, 4, 6, 8 und 12 Wassermolekülen assoziiert sind. Magnesiumsulfat ist eine anorganische Verbindung mit der chemischen Formel MGSO4. Die Molmasse der wasserfreien Form beträgt 120.36 g/mol. Darüber hinaus umfassen die häufigen hydratisierten Formen Magnesiumsulfat, die mit 1, 4, 5, 6 und 7 Wassermolekülen assoziiert sind.
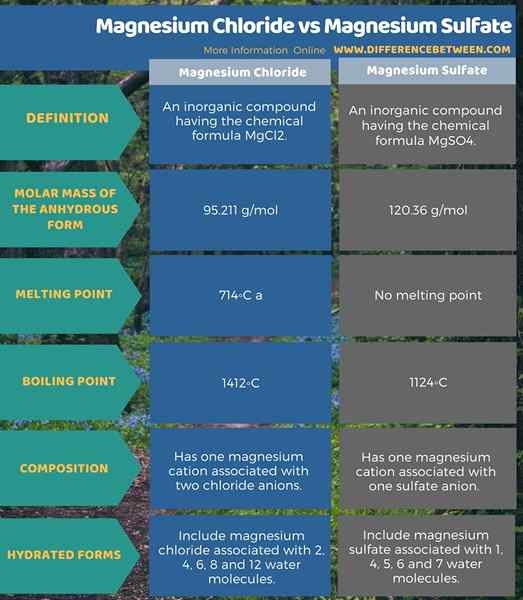
Zusammenfassung -Magnesiumchlorid gegen Magnesiumsulfat
Magnesium ist ein chemisches Element der Gruppe 2, das stabile, zweiwertige Kationen bilden kann, die ionische Verbindungen bilden können. Magnesiumchlorid ist ein ionisches Halogenid, und Magnesiumsulfat ist ein Magnesiumsalz. Der Unterschied zwischen Magnesiumchlorid und Magnesiumsulfat besteht darin.
Referenz:
1. "Magnesiumchlorid.Wikipedia, Wikimedia Foundation, 19. Juni 2018.Hier verfügbar
2. "Magnesiumsulfat.Wikipedia, Wikimedia Foundation, 19. Juni 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1."Magnesiumchlorid" (Public Domain) über Commons Wikimedia
2."Magnesiumsulfat wasserfrei" (öffentlich zugänglich) über Commons Wikimedia


