Unterschied zwischen Mizellen und kolloidalen Partikeln
Der Schlüsselunterschied Zwischen Mizellen und kolloidalen Partikeln ist das Mizellen bilden sich in einer bestimmten Konzentration, während sich kolloidale Partikel bilden, sobald die gelösten Stoffe zum Lösungsmittel zugesetzt werden.
Die Begriffe Mizellen und kolloidale Partikel sind in der analytischen Chemie enthalten, in denen Kolloide diskutiert werden. Mizellen sind auch eine Art kolloidale Partikel.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind Mizellen
3. Was sind kolloidale Partikel
4. Seite an Seitenvergleich - Mizellen gegen kolloidale Partikel in tabellarischer Form
5. Zusammenfassung
Was sind Mizellen?
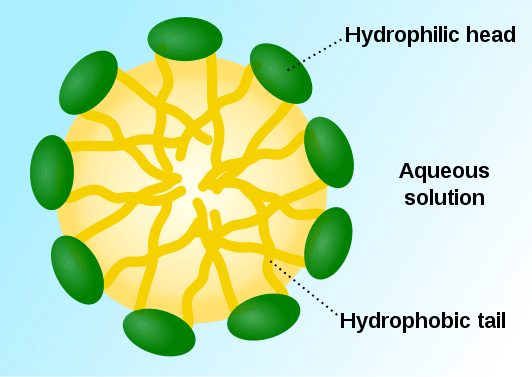
Mizellen sind kolloidale Partikel, die sich als Aggregate von Tensidmolekülen bilden. Diese werden in einem flüssigen Medium verteilt und treten als flüssige Kolloide auf. Tensidmoleküle haben hydrophile Köpfe und hydrophobe Schwänze. In einem wässrigen Medium neigen hydrophobe einzelnen Schwanzstrukturen dazu, Wassermoleküle abzuwehren, während die hydrophilen Köpfe dazu neigen, die Wassermoleküle anzuziehen. Infolgedessen bildet sich ein Aggregat so, dass hydrophile Köpfe mit dem Lösungsmittel in Kontakt stehen und die hydrophoben Schwänze in der Mizelle umgeben.

Abbildung 01: Struktur einer typischen Mizelle
Mizellen sind kugelförmig in ihrer Form. Darüber hinaus sind auch einige andere Formen wie Ellipsoide, zylindrische Strukturen und Doppelschichten möglich. Die Form der Mizelle wird durch einige Faktoren bestimmt. Der Prozess der Mizellenbildung wird als Mizellisierung bezeichnet.
Darüber hinaus bilden sich Mizellen, wenn die Konzentration des Tensids größer ist als die kritische Mizellenkonzentration der Lösung. Auch die Temperatur des Systems muss höher sein als die kritische Mizellentemperatur. Normalerweise bilden sich Mizellen aufgrund des Gleichgewichts zwischen Entropie und Enthalpie der Tensid-Lösungsmittel-Mischung spontan.
Was sind kolloidale Partikel?
Kolloidale Partikel sind die Partikel, die in einer Suspension verteilt sind. Diese Art von Suspension wird als kolloidale Suspension bezeichnet. Die suspendierten Partikel können entweder lösliche oder unlösliche Partikel sein. Ein Kolloid hat zwei Unterscheidungsphasen der Materie: Flüssigphasenlösungsmittel und feste Phasenpartikel. Die flüssige Phase wird als kontinuierliche Phase bezeichnet, und die feste Phase wird als dispergierte Phase bezeichnet, die im gesamten Lösungsmittel dispergiert wird. Normalerweise setzen sich kolloidale Partikel nicht ab oder brauchen sich nicht sehr lange, um sich niederzulassen.

Abbildung 02: In Milch sind kolloidale Partikel Butterfettkügelchen
Kolloidale Partikel sind durch ein optisches Mikroskop leicht sichtbar. Einige Kolloide sind undurchsichtig, aber einige sind durchscheinend. Die durchscheinende Natur ist auf den Tyndall -Effekt der Lichtstreuung zurückzuführen. Je nach Art der flüssigen Phase und der dispergierten Phase gibt es verschiedene Arten von Kolloiden. Follower sind einige Beispiele.
- Wenn das Lösungsmittel flüssig ist und die dispergierte Phase Gas ist, nennen wir diesen Kolloid Schaum. Die kolloidalen Partikel sind gasförmige Aggregate. E.G. Schlagsahne.
- Wenn das Lösungsmittel eine feste und dispergierte Phase ist, nennen wir es ein Gas fester Schaum. Hier sind auch die kolloidalen Partikel gasförmige Aggregate. E.G. Luftschleg.
- Wenn die Lösungsmittelphase Gas ist und die dispergierte Phase flüssig ist, nennen wir es Flüssiges Aerosol. Die kolloidalen Partikel sind flüssige Aggregate. E.G. Sprays.
- Wenn die Lösungsmittelphase flüssig ist und die dispergierte Phase auch flüssig ist, nennen wir es eine Emulsion. E.G. Milch.
- Wenn die Lösungsmittelphase fest ist und die dispergierte Phase flüssig ist, nennen wir es a Gel. Die kolloidalen Partikel hier sind flüssige Aggregate. E.G. Agar.
- Wenn die Lösungsmittelphase Gas ist und die dispergierte Phase fest ist, nennen wir es Festes Aerosol. E.G. Rauch.
- Wenn die Lösungsmittelphase flüssig ist und die dispergierte Phase fest ist, nennen wir sie als “als“Sol”. Die kolloidalen Partikel hier sind feste Aggregate. E.G. Blut.
- Wenn die Lösungsmittelphase fest ist und das dispergierte Medium ebenfalls solide ist, nennen wir es Solid Sol. Die kolloidalen Partikel hier sind feste Aggregate. E.G. Cranberryglas.
Was ist der Unterschied zwischen Mizellen und kolloidalen Partikeln?
Mizellen sind auch eine Art kolloidale Partikel. Der Schlüsselunterschied zwischen Mizellen und kolloidalen Partikeln besteht darin, dass sich Mizellen in einer bestimmten Konzentration bilden, während sich kolloidale Partikel bilden. Außerdem bilden sich Mizellen aufgrund der hydrophilen und hydrophoben Wirkungen, während sich kolloidale Partikel aufgrund der Inlöslichkeit oder Sättigung der Lösung bilden.
Darüber hinaus kann die Größe der Mizellen zwischen 2 und 20 Nanometern variieren, während die Größe der kolloidalen Partikel zwischen 1 und 1000 Nanometern variieren kann.
Die folgende Tabelle zeigt mehr Vergleiche im Zusammenhang mit dem Unterschied zwischen Mizellen und kolloidalen Partikeln.

Zusammenfassung -Mizellen gegen kolloidale Partikel
Die Begriffe Mizellen und kolloidale Partikel sind in der analytischen Chemie enthalten, in denen Kolloide diskutiert werden. Mizellen sind auch eine Art kolloidale Partikel. Der Schlüsselunterschied zwischen Mizellen und kolloidalen Partikeln besteht darin, dass sich Mizellen in einer bestimmten Konzentration bilden, während sich kolloidale Partikel bilden.
Referenz:
1. „Micelle.” Encyclopædia Britannica, Encyclopædia Britannica, Inc., 2. Februar. 2018, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Micelle Scheme-en" von Supermanu-eigene Arbeit (CC BY-SA 3.0) über Commons Wikimedia
2. "Glas Milch auf Tischdecke" von I, Chedid (CC BY-SA 3.0) über Commons Wikimedia


