Unterschied zwischen geschmolzener und wässriger Elektrolyse
Der Schlüsselunterschied Zwischen geschmolzener und wässriger Elektrolyse ist das Die geschmolzene Elektrolyse produziert Elemente des Analyten, während wässrige Elektrolyse eine wässrige Salzlösung und eine Mischung von Gasen als Endprodukt erzeugt.
Moldene und wässrige Elektrolyse sind zwei Arten von Elektrolyseverfahren in der analytischen Chemie, die sich je nach Eigenschaften des Elektrolytmediums voneinander unterscheiden. Der Begriff „geschmolzen“ bezieht sich auf den flüssigen Zustand des Analyten in Abwesenheit von Wasser, während sich der Begriff „wässrig“ auf den flüssigen Zustand in Gegenwart von Wasser bezieht.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist geschmolzene Elektrolyse
3. Was ist wässrige Elektrolyse
4. Seite an Seitenvergleich - geschmolzen gegen wässrige Elektrolyse in tabellarischer Form
5. Zusammenfassung
Was ist geschmolzene Elektrolyse?
Die geschmolzene Elektrolyse ist eine Technik in der analytischen Chemie, die einen elektrischen Strom verwendet, um die chemischen Elemente in einer Analytsubstanz in seinem geschmolzenen Zustand zu trennen. Im Allgemeinen werden in dieser Art von Elektrolyseverfahren ionische Verbindungen verwendet. Diese Technik liefert Informationen darüber, wie wir Metalle wie Aluminium und Natrium aus ihren geschmolzenen Verbindungen mit einem elektrischen Strom extrahieren können.
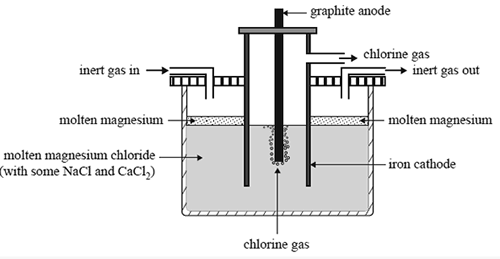
Abbildung 01: Extraktion von Magnesiummetall
Zum Beispiel ist Aluminium das am häufigsten vorkommende Metall auf der Erdoberfläche, aber es kommt nicht in einem reinen Zustand in der Natur vor. Stattdessen tritt es als ionische Verbindungen in Mineralien auf. Daher müssen wir Aluminium durch Elektrolyse von seinen Verbindungen trennen. Hier verwenden wir eine geschmolzene ionische Verbindung. Eine ionische Verbindung bildet sich aufgrund der Bildung einer starken ionischen Bindung, die zwischen Kationen und Anionen besteht. Im Festkörper einer ionischen Verbindung sind die Anionen und Kationen in einer starren Struktur eingesperrt, sodass sie keinen Strom leiten können. Daher können wir keine feste Verbindung zur Elektrolyse verwenden. In ihrem geschmolzenen Zustand trennt sich die ionische Verbindung jedoch in Anionen und Kationen, sodass der geschmolzene Zustand des Analyten Strom leiten kann. Wir können den geschmolzenen Zustand durch Schmelzen des Feststoffs bekommen. Daher können wir den geschmolzenen Zustand des Analyten als Elektrolyt benennen.
Während des Prozesses der geschmolzenen Elektrolyse bewegen sich die Kationen in Richtung der negativen Elektrode, während sich Anionen in Richtung der positiven Elektrode bewegen. An der negativen Elektrode (Kathode) gewinnen Kationen Elektronen und werden zu Atomen. An der positiven Elektrode oder der Anode verlieren Ionen Elektronen, um Atome zu werden.
Was ist wässrige Elektrolyse?
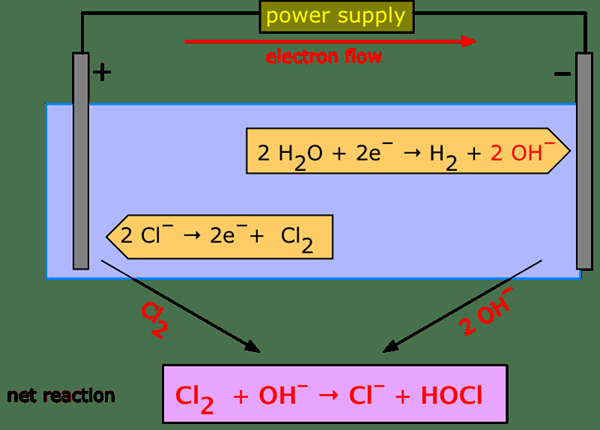
Die wässrige Elektrolyse ist eine Technik in der analytischen Chemie, die einen elektrischen Strom verwendet, um die chemischen Elemente in einem Analytensubstanz in seinem wässrigen Zustand zu trennen. Diese Art der Elektrolyse ist wichtig, um bestimmte Substanzen oder Gase zu erhalten. Wenn wir beispielsweise einen elektrischen Strom durch Wasser übergeben, bildet er Wasserstoffgas und Sauerstoffgas.

Abbildung 02: Elektrolyse von Wasser
Bei der wässrigen Elektrolyse wird ein elektrischer Strom durch einen ionisierten Elektrolyten geleitet; Hier bewegen sich die Kationen zur Anode und die Anionen bewegen sich in Richtung der Kathode. Diese Art von System wird als elektrolytische Zelle bezeichnet. Es gibt viele Anwendungen der wässrigen Elektrolyse, einschließlich Elektroplatten, Neustoffe in Aluminium, Herstellung von Chlor- und Ätznatronen aus Tischsalz usw.
Was ist der Unterschied zwischen geschmolzener und wässriger Elektrolyse?
Molkene und wässrige Elektrolyse sind analytische Techniken in der Chemie, die bei der Trennung chemischer Elemente in der Analytensubstanz nützlich sind. Der Schlüsselunterschied zwischen geschmolzener und wässriger Elektrolyse besteht darin, dass die geschmolzene Elektrolyse Elemente des Analyten erzeugt, während wässrige Elektrolyse eine wässrige Salzlösung und eine Mischung von Gasen als Endprodukt erzeugt.
Die folgende Infografik zeigt mehr Vergleiche im Zusammenhang mit dem Unterschied zwischen geschmolzener und wässriger Elektrolyse.
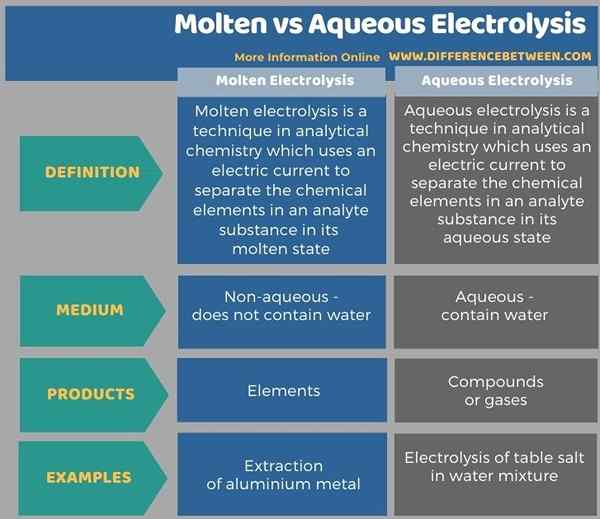
Zusammenfassung -geschmolzen gegen wässrige Elektrolyse
Die Elektrolyse ist eine Technik in der analytischen Chemie, die die Verwendung von Elektrizität zur Trennung von Elementen in einer Substanz umfasst. Geschmolzene und wässrige Elektrolyse sind zwei solcher Arten der Elektrolyse. Der Schlüsselunterschied zwischen geschmolzener und wässriger Elektrolyse besteht darin, dass die geschmolzene Elektrolyse Elemente des Analyten erzeugt, während wässrige Elektrolyse eine wässrige Salzlösung und eine Mischung von Gasen als Endprodukt erzeugt.
Referenz:
1. „Elektrolyse von geschmolzenen Verbindungen." Lernen.com, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Mg durch Elektrolyse" von Raveendra R.S. - Eigene Arbeit (CC BY-SA 4.0) über Commons Wikimedia
2. "Wasserelektrolyse NaCl" von langsamer - eigene Arbeit (CC BY -SA 3.0) über Commons Wikimedia


