Unterschied zwischen N -Glykosylierung und O -Glykosylierung
Der Schlüsselunterschied Zwischen der N -Glykosylierung und der O -Glykosylierung ist Diese N -Glykosylierung tritt in Asparaginresten auf, während in der Seitenkette von Serin- oder Threoninresten eine Glykosylierung auftritt.
Die Glykosylierung ist die kontrollierte enzymatische Modifikation eines organischen Moleküls wie ein Protein über die Zugabe eines Zuckermoleküls. Es ist ein wichtiger biochemischer Prozess und ein stark regulierter Mechanismus der sekundären Proteinverarbeitung innerhalb der Zellen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist N -Glykosylierung
3. Was ist eine Glykosylierung
4. Seite für Seitenvergleich - n Glykosylierung gegen die O -Glykosylierung in tabellarischer Form
5. Zusammenfassung
Was ist N -Glykosylierung?
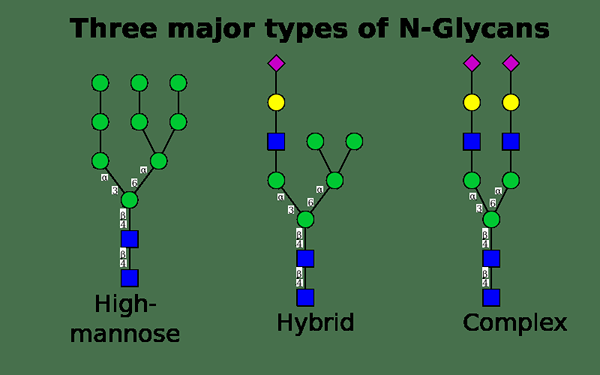
N Glykosylierung oder N-verknüpfte Glykosylierung ist die Anhaftung eines Oligosaccharid-Zuckermoleküls an ein Stickstoffatom im Asparaginrest eines Proteinmoleküls. Dieses Zuckermolekül wird auch als Glycan bezeichnet. Es ist an das Stickstoffatom in der Amidgruppe des Sparaginrestes gebunden. Darüber hinaus ist dieser Verknüpfungsprozess sowohl für die Struktur als auch für die Funktion einiger eukaryotischer Proteine wichtig. Darüber hinaus findet dieser Prozess in Eukaryoten, weit verbreitet in Archaea und selten in Bakterien statt.
Die Bindung eines Glycanrestes an ein Protein erfordert die Erkennung einer Konsenssequenz. Zum Beispiel sind N-verknüpfte Glykane fast immer am Stickstoffatom einer Sparagin-Seitenkette gebunden, die als Teil der ASN-X-Ser/Thr-Konsenssequenz auftritt. Hier ist X jede Aminosäure außer Prolin (Pro). Die N-verknüpften Glykane haben sowohl intrinsische als auch extrinsische Funktionen.

Abbildung 01: Arten von N-Glykanen
Es gibt wichtige klinische Anwendungen des N -Glykosylierungsprozesses. Zum Beispiel ist es mit unterschiedlichen Krankheiten verbunden, einschließlich rheumatoider Arthritis, Typ -1 -Diabetes, Morbus Crohn und Krebserkrankungen. Darüber hinaus sind viele therapeutische Proteine auf dem Markt Antikörper, die N-verknüpfte Glykoproteine sind.
Was ist eine Glykosylierung?
O Glykosylierung oder O-verknüpfte Glykosylierung ist die Anhaftung eines Zuckermoleküls an das Sauerstoffatom von Serin- oder Threoninresten in einem Proteinmolekül. Dieser Prozess ist eine posttransitionsale Modifikation, die nach der Synthese des Proteins auftritt. Dieser Prozess kann sowohl in Eukaryoten als auch in Prokaryoten stattfinden. E.G. In Eukaryoten tritt die N -Glykosylierung im endoplasmatischen Retikulum, im Golgi -Apparat und manchmal im Zytoplasma auf, während sie in Prokaryoten im Zytoplasma auftritt.
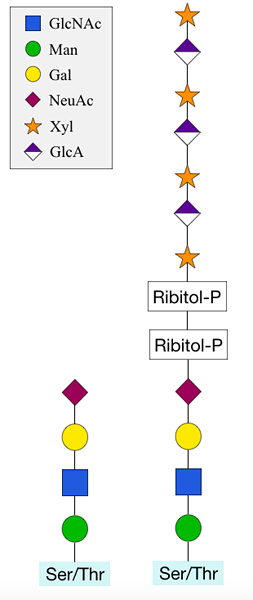
Abbildung 02: Zugabe von Ribitolzucker
Während des O -Glykosylierungsprozesses können zum Serin oder Threonin mehrere Zucker zugesetzt werden, und diese Ergänzung kann das Protein auf unterschiedliche Weise beeinflussen, indem die Proteinstabilität verändert und die Proteinaktivität reguliert wird.
Was ist der Unterschied zwischen der N -Glykosylierung und der O -Glykosylierung?
N -Glykosylierung und O -Glykosylierung sind wichtige biochemische Prozesse. Der Schlüsselunterschied zwischen der N -Glykosylierung und der O -Glykosylierung besteht darin, dass die N -Glykosylierung in Asparaginresten auftritt. Hauptsächlich nimmt die N -Glykosylierung in eukaryotischen Organismen und in Archaea auf, während eine Glykosylierung nur in prokaryotischen Organismen auftritt.
Nachfolgend finden Sie eine zusammenfassende Tabelle des Unterschieds zwischen der N -Glykosylierung und der O -Glykosylierung.

Zusammenfassung -N -Glykosylierung gegen O -Glykosylierung
Kurz gesagt, die N-Glykosylierung oder eine N-verknüpfte Glykosylierung ist die Anhaftung eines Oligosaccharid-Zuckermoleküls an ein Stickstoffatom im Asparaginrest eines Proteinmoleküls. O Glykosylierung oder O-verknüpfte Glykosylierung ist die Anhaftung eines Zuckermoleküls an das Sauerstoffatom von Serin- oder Threoninresten in einem Proteinmolekül. Daher besteht der Schlüsselunterschied zwischen der N -Glykosylierung und der O -Glykosylierung darin, dass die N -Glykosylierung in Asparaginresten auftritt.
Referenz:
1. „Verbundene Glykosylierung.Science Direct. Hier verfügbar.
Bild mit freundlicher Genehmigung:
1. "Arten von Glykanen" von DNA 621 - eigene Arbeit (CC BY -SA 3.0) über Commons Wikimedia
2. "Gemeinsame O-Glycans, die auf Alpha-Dystroglycan gefunden wurden" von Waffeln-eigene Arbeit (CC BY-SA 4).0) über Commons Wikimedia


