Unterschied zwischen Protium und Deuterium

Der Schlüsselunterschied Zwischen Protium und Deuterium ist das Protium hat keine Neutronen in seinem Atomkern, während Deuterium ein Neutron hat.
Protium und Deuterium sind Wasserstoffisotope. Daher unterscheiden sie sich je nach Anzahl der in ihren Atomkernen vorhandenen Neutronen voneinander. Wasserstoff enthält ein Proton im Atomkern: Somit beträgt die Atomzahl von Wasserstoff 1. Es gibt drei Wasserstoffisotope. Alle drei Isotope enthalten auch ein Proton. Wir können die drei Isotope als bezeichnen 1H, 2Hand 3H. Die Werte in SuperScript sind die Atommassen dieser Elemente.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Protium
3. Was ist Deuterium
4. Seite an Seitenvergleich - Protium gegen Deuterium in tabellarischer Form
5. Zusammenfassung
Was ist Protium?
Protium ist ein Wasserstoff, das ein Proton und ein Elektron enthält. Es hat keine Neutronen im Atomkern. Daher gibt es im Kern nur ein einzelnes Proton. Dieses Isotop wird aufgrund der Anwesenheit dieses einzelnen Protons als solches bezeichnet. Wir können bezeichnen, ist als als 1H oder Wasserstoff-1, wobei 1 die Atommasse des Protiums ist.

Protium ist das häufigste und reichlichste Isotop von Wasserstoff. Die Fülle beträgt ungefähr 99%. Dies wird als stabiles Isotop angesehen, da das Proton in diesem Atom nie beobachtet wurde. Nach den Theorien wird jedoch ein Verfall mit einer sehr großen Halbwertszeit erfasst, so dass es nicht beobachtet werden kann.
Was ist Deuterium?
Deuterium ist ein Wasserstoff mit einem Proton, einem Neutron und einem Elektron. Im Gegensatz zu Protium hat dieses Isotop ein Proton und ein Neutron zusammen im Atomkern zusammen. Daher beträgt die Atommasse dieses Isotops 2. Dann können wir es als Wasserstoff-2 oder nennen 2H. Deuterium ist auch ein stabiles Isotop von Wasserstoff. Es ist jedoch im Vergleich zu Protium nicht reichlich vorhanden. Die Häufigkeit variiert zwischen 0.0026-0.0184%. Im Gegensatz zu Tritium ist Deuterium kein radioaktiv. Es zeigt auch keine Toxizität.
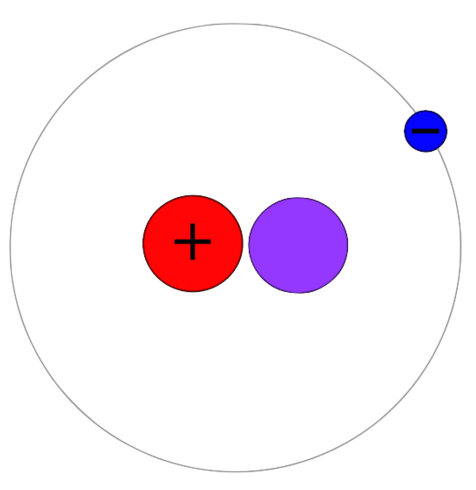
Wasser enthält normalerweise Wasserstoff-1 kombiniert mit Sauerstoffatomen. Aber es kann Wasserstoff-2 in Kombination mit Sauerstoff geben, das Wasser bildet. Es ist schweres Wasser. Die chemische Formel für schweres Wasser ist D2O Wo d ist Deuterium und o Sauerstoff. Darüber hinaus können wir Deuterium und seine Verbindungen in chemischen Experimenten verwenden. Beispielsweise sind sie als nicht radioaktive Bezeichnungen in Experimenten wie bei der NMR-Spektroskopie nützlich. Darüber hinaus können wir schweres Wasser als Neutronenmoderator und Kühlmittel für Kernreaktoren verwenden. Deuterium ist auch ein Brennstoff für die Kernspaltung, die im kommerziellen Maßstab durchgeführt wird.
Was ist der Unterschied zwischen Protium und Deuterium?
Es gibt drei Wasserstoffisotope: Protium, Deuterium und Tritium. Der Hauptunterschied zwischen Protium und Deuterium besteht darin, dass Protium keine Neutronen in seinem Atomkern aufweist, während Deuterium ein Neutron hat. Daher unterscheiden sich die drei Isotope je nach Anzahl der in ihren Atomkernen vorhandenen Neutronen. Aus diesem Grund beträgt die Atommasse des Protiums 1, während die Atommasse von Deuterium 2 beträgt.
Darüber hinaus können wir das Protiumisotop entweder als Wasserstoff-1 oder bezeichnen 1H und das Deuterium-Isotop entweder als Wasserstoff-2 oder als Wasserstoff oder 2H. Das Protium ist das am häufigsten vorkommende Wasserstoffisotop und seine Häufigkeit beträgt etwa 99%. Deuterium ist vergleichsweise weniger häufig (ungefähr 0.002%). Es ist jedoch auch als Protium stabil.
Die folgende Infografik fasst den Unterschied zwischen Protium und Deuterium zusammen.

Zusammenfassung -Protium gegen Deuterium
Es gibt drei Wasserstoffisotope: Protium, Deuterium und Tritium. Diese drei Isotope unterscheiden. Der Hauptunterschied zwischen Protium und Deuterium besteht darin, dass Protium keine Neutronen in seinem Atomkern aufweist, während Deuterium ein Neutron hat.
Referenz:
1. Helmenstine, Anne Marie. „Ist Deuterium radioaktiv?Denkweise Mai. 20, 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Wasserstoff" von METS501 - eigene Arbeit (CC BY -SA 3.0) über Commons Wikimedia
2. "H -2 Atom" von Zyjacklin - eigene Arbeit (CC0) über Commons Wikimedia


