Unterschied zwischen PX PY und PZ -Orbitalen
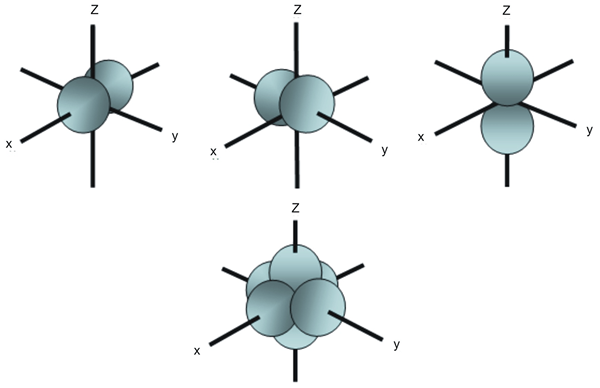
Der Hauptunterschied zwischen PX PY und PZ -Orbitalen ist, dass die Das PX-Orbital hat zwei Lappen entlang der x-Achse und das Py-Orbital hat zwei Lappen entlang der y-Achse, während das PZ-Orbital zwei Lappen entlang der Z-Achse ausgerichtet ist. Daher ergibt sich der Unterschied zwischen PX PY und PZ -Orbitalen aus ihrer Ausrichtung im Raum.
Ein atomares Orbital ist eine Region um einen Atomkern, der die höchste Wahrscheinlichkeit hat, ein Elektron zu finden. Die Orbitale eines Atom. Darüber hinaus gibt es drei P -Orbitale; Sie sind PX-, PY- und PZ -Orbitale.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist ein PX -Orbital
3. Was ist ein PY -Orbital
4. Was ist ein PZ -Orbital
5. Ähnlichkeiten zwischen PX PY und PZ -Orbitalen
6. Seite an Seite Vergleich - PX vs Py vs Pz Orbitale in tabellarischer Form
7. Zusammenfassung
Was ist ein PX -Orbital?
PX Orbital ist eines von drei P-Orbitalen und -Orlenten entlang der x-Achse. Darüber hinaus hat dieses Orbital zwei Lappen und eine Hantelform. Quantennummern sind eine Reihe von Zahlen, die dazu beitragen, Atomorbitale zu benennen. Dieses System gibt ein bestimmtes Atom -Orbital einen eindeutigen Namen.

Abbildung 1: verschiedene P -Orbitale und ihre Orientierungen
Quantenzahlen:
- Prinzip Quantenzahl (n) beschreibt die Elektronenschale. Ex: n = 1, 2, 3…
- Azimutale Quantenzahl oder die Quantenzahl (L) der Winkelmomplum erklärt die Unterschalen. Bsp. L = 0, 1, 2…
- Magnetische Quantenzahl (m) gibt den eindeutigen Quantenzustand eines Elektrons an. Ex: M =… -2, -1, 0, +1, +2…
- Die Spinquantenzahl beschreibt den Spin eines Elektrons. Ex: s = ±
Bei der Betrachtung des PX -Orbitals lautet die Quantennotation wie folgt.
- Wenn n = 1, gibt es keine P -Orbitale.
- Wenn n> 2 und L = 1, gibt es p -Orbitale. Dann ist PX entweder M = +1 oder m = -1.
- Mit den zunehmenden N -Werten nimmt die Größe des Außenlappens des PX -Orbitals allmählich zu, während die Größe der Innenlappen abnimmt.
Was ist ein PY -Orbital?
PY-Orbital ist eines von drei P-Orbitalen, die entlang der y-Achse orientiert sind. Dieses Orbital hat zwei Lappen. Die Quantennotation des PY -Orbitals lautet wie folgt.
- Wenn n = 1, gibt es keine P -Orbitale.
- Wenn n> 2 und L = 1, gibt es p -Orbitale. Dann ist PY entweder m = +1 oder m = -1.
- Mit den zunehmenden N -Werten nimmt die Größe des Außenlappens des PY -Orbitals allmählich zu, während die Größe der inneren Lappen abnimmt.
Was ist ein PZ -Orbital?
PZ-Orbital ist eines von drei P-Orbitalen, die entlang der Z-Achse orientiert sind. Dieses Orbital hat zwei Lappen und eine Hantelform. Die Quantennotation von PY -Orbital lautet wie folgt:
- Wenn n = 1, gibt es keine P -Orbitale.
- Wenn n> 2 und L = 1, gibt es p -Orbitale. Dann ist PZ entweder m = 0.
- Mit den zunehmenden N -Werten nimmt die Größe des Außenlappens des PZ -Orbitals allmählich zu, während die Größe der Innenlappen abnimmt.
Was sind die Ähnlichkeiten zwischen PX PY und PZ -Orbitalen?
- PX PY- und PZ -Orbitale haben eine ähnliche Form (Hantelform).
- Alle drei P -Orbitale haben eine ähnliche Größe.
- Die Größen dieser Orbitale ändern sich mit der Erhöhung des N -Werts.
- Alle drei Orbitale enthalten zwei Lappen entlang derselben Achseausrichtung.
Was ist der Unterschied zwischen PX PY und PZ -Orbitalen?
Px py vs pz Orbitale | ||
| PX Orbital ist ein P-Orbital, das entlang der x-Achse ausgerichtet ist. | PY-Orbital ist ein P-Orbital, das entlang der Y-Achse orientiert ist. | PZ-Orbital ist ein P-Orbital, das entlang der Z-Achse ausgerichtet ist. |
| Orientierung | ||
| Entlang der x-Achse | Entlang der Y-Achse | Entlang der Z-Achse |
| Wert der magnetischen Quantenzahl (m) | ||
| Der Wert für die magnetische Quantenzahl (m) beträgt entweder +1 oder -1. | Der Wert für die magnetische Quantenzahl (m) beträgt entweder +1 oder -1 | Der Wert für die magnetische Quantenzahl (m) beträgt 0 (Null) |
Zusammenfassung -PX PY gegen PZ -Orbitale
In einem Atom befinden sich drei P -Atom -Orbitale. Die Namen PX, PY und PZ geben die Ausrichtung des Orbitals im Weltraum an. Der wichtigste Unterschied zwischen PX PY- und PZ-Orbitalen besteht darin, dass PX-Orbital zwei Lappen entlang der x-Achse ausgerichtet hat und das PY-Orbital zwei Lappen entlang der y-Achse ausgerichtet ist, während das PZ-Orbital zwei Lappen entlang der Z-Achse ausgerichtet ist.
Referenz:
1. „Atomic Orbital.”Wikipedia, Wikimedia Foundation, 24. April. 2018, hier erhältlich.
2. Libretexten. „Atomarbitale.”Chemie libretexten, libretexten, 7. Februar. 2018, hier erhältlich.
3. Agray, Santosh. „Formen der Orbitale.Chemistry Desk, hier erhältlich.
Bild mit freundlicher Genehmigung:
1.”PX PY PZ -Orbitale“ von CK -12 Foundation - Datei: High School Chemistry.PDF, Seite 268 (CC BY-SA 3.0) über Commons Wikimedia


