Unterschied zwischen Raoult Law und Dalton Law
Der Schlüsselunterschied Zwischen Raoult Law und Dalton Law ist das Das Raoult-Gesetz befasst sich mit dem Dampfdruck von Festkörpern oder Flüssigkeiten, während das Dalton-Gesetz mit dem Teildruck von nicht reagierenden Gasen befasst.
Raoult Law und Dalton Law sind sehr wichtige Gesetze in der Chemie, die den teilweisen Druck von gasförmigen Zuständen erklären. Das Raoult -Gesetz beschreibt das Verhalten des Teilungsdrucks von Dampf einer Lösung, wenn die Konzentration der gelösten Stoffe geändert wird. Im Gegensatz dazu beschreibt Dalton Law das Verhalten nicht reagierender Gase im selben Schiff.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Raoultgesetz
3. Was ist Dalton Law
4. Seite an Seite Vergleich - Raoultgesetz gegen Dalton -Gesetz in tabellarischer Form
6. Zusammenfassung
Was ist Raoultgesetz?
Raoultgesetz besagt, dass der Dampfdruck eines Lösungsmittels über einer Lösung dem Dampfdruck des reinen Lösungsmittels bei derselben Temperatur entspricht. Wir können diese Beziehung mathematisch wie folgt geben:
PLösung= XLösungsmittel.PÖLösungsmittel
Wo pSoltuion ist der Dampfdruck der Lösung, xLösungsmittel ist der Maulwurfsanteil des Lösungsmittels und pÖLösungsmittel ist der Dampfdruck des reinen Lösungsmittels. Das Gesetz wurde 1880 vom französischen Chemiker François-Marie Raoult entwickelt. Er entdeckte, dass beim Zugabe eines gelösten Stoffes zu einer Lösung der Dampfdruck der Lösung allmählich abnimmt. Diese Beobachtung war jedoch von zwei Variablen abhängig: Molanteil des gelösten gelösten gelösten Stoff- und Dampfdrucks des reinen Lösungsmittels.
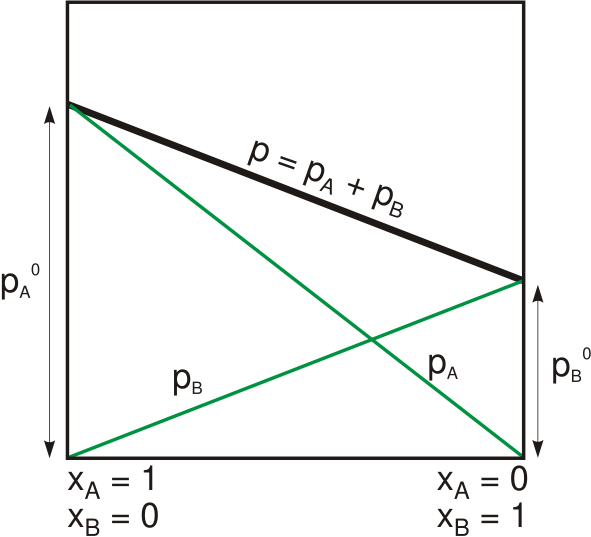
Abbildung 01: Dampfdruck einer binären Lösung, die dem Raoult -Gesetz folgt
Bei einem bestimmten Druck für einen bestimmten Feststoff oder eine bestimmte Flüssigkeit gibt es einen Druck, bei dem der Dampf der Substanz mit der Substanz in fester oder flüssiger Form im Gleichgewicht ist. Bei dieser Temperatur nennen wir den Druck über der Substanz als Dampfdruck. Darüber hinaus ist bei diesem Gleichgewicht die Geschwindigkeit der Verdunstung von festen oder flüssigen Substanzen gleich dem Dampf. Dies ist also die Grundtheorie hinter dem Raoultgesetz. Raoult Law arbeitet jedoch für ideale Lösungen. Es funktioniert aber auch gut mit Lösungsmitteln in einem sehr verdünnten Zustand. Für reale Substanzen (nicht ideale Substanzen) ist die Abnahme des Dampfdrucks praktisch größer als der Wert, den wir aus dem Raoultgesetz berechnen.
Was ist Dalton Law?
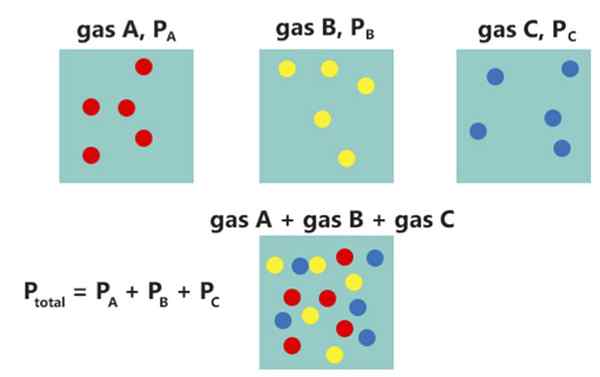
Das Dalton-Gesetz besagt, dass der Gesamtdruck einer Mischung aus nicht reagierenden Gasen der Summe des Teildrucks jedes Gases entspricht. Das Gesetz wurde 1802 von John Dalton entwickelt. Wir können dieses Gesetz mathematisch wie folgt geben:
Pgesamt= Pich
Wo pgesamt ist der Gesamtdruck des Gasgemisches, während pich ist der Teildruck jedes einzelnen Gases.

Abbildung 02: Dalton Law
Wenn wir beispielsweise ein nicht reagierendes Gasgemisch mit drei Komponenten haben, können wir die Beziehung wie folgt schreiben:
Pgesamt = P1+P2+P3
Was ist der Unterschied zwischen Raoult Law und Dalton Law?
Das Raoult -Recht und das Dalton -Recht sind sehr wichtige Gesetze in der Chemie, die den Teil des Teils gasöser Zustände erklären. Der Hauptunterschied zwischen Raoult Law und Dalton Law besteht darin, dass sich das Raoultgesetz mit dem Dampfdruck von Festkörpern oder Flüssigkeiten befasst, während sich das Dalton-Gesetz mit dem Teildruck nicht reagierender Gase befasst. Das ist; Das Raoultgesetz besagt, dass der Dampfdruck eines Lösungsmittels über einer Lösung dem Dampfdruck des reinen Lösungsmittels bei derselben Temperatur entspricht. In der Zwischenzeit besagt das Dalton-Gesetz, dass der Gesamtdruck einer Mischung nicht reagierender Gase der Summe der Teildrücke jedes Gases entspricht. Der mathematische Ausdruck für Raoultgesetz ist pLösung= XLösungsmittel.PÖLösungsmittel Während der mathematische Ausdruck für Dalton Law p ist pgesamt= Pich.

Zusammenfassung -Raoult Law gegen Dalton Law
Das Raoult -Recht und das Dalton -Recht sind sehr wichtige Gesetze in der Chemie, die den Teil des Teils gasöser Zustände erklären. Der Hauptunterschied zwischen Raoult Law und Dalton Law besteht jedoch darin, dass sich das Raoultgesetz mit dem Dampfdruck von Festkörpern oder Flüssigkeiten befasst, während sich das Dalton-Gesetz mit dem Teildruck nicht reagierender Gase befasst.
Referenz:
1. Helmenstine, Anne Marie. „Raoult's Law Definition in der Chemie.”Thoughtco, Jan. 9, 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Raoultov Zakon" (Public Domain) über Commons Wikimedia
2. "Schema, das Daltons Gesetz darstellt" von Blyumj - eigener Arbeit (CC BY -SA 4.0) über Commons Wikimedia


