Differenz zwischen Ratenausdruck und Ratengesetz

Der Schlüsselunterschied Zwischen Ratenausdruck und Ratengesetz ist das Der Ratenausdruck gibt die Erscheinungsrate oder das Verschwinden von Produkten oder Reaktanten an, während das Ratengesetz die Beziehung zwischen Geschwindigkeit und Konzentration oder dem Druck von Reaktanten ergibt.
Wenn ein oder mehrere Reaktanten in Produkte umgewandelt werden, können sie unterschiedliche Modifikationen und Energieveränderungen durchlaufen. Die chemischen Bindungen in den Reaktanten brechen und neue Bindungen werden gebildet, um Produkte zu erzeugen, die sich völlig von den Reaktanten unterscheiden. Diese chemische Modifikation wird als chemische Reaktionen bezeichnet. Ratenausdruck und Ratengesetz sind wichtige chemische Konzepte, die wir bei chemischen Reaktionen beschreiben können.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Ratenausdruck
3. Was ist Ratengesetz
4. Seite für Seitenvergleich - Ratenausdruck gegen Rate -Gesetz in tabellarischer Form
5. Zusammenfassung
Was ist Ratenausdruck?
Die Geschwindigkeitsausdruck ist die Möglichkeit, die Änderung der Reaktantenkonzentration über den Zeitpunkt der Reaktion darzustellen. Wir können diesen Ausdruck unter Verwendung eines der Reaktanten und Produkte der Reaktion geben. Wenn wir den Geschwindigkeitsausdruck in Bezug auf Reaktanten geben, sollten wir ein Minuszeichen verwenden, da während der Reaktion die Reaktantenmenge mit der Zeit abnimmt. Beim Schreiben des Ratenausdrucks mit Produkten und Schild wird verwendet, da die Produktmenge mit der Zeit zunimmt.
Darüber hinaus sollten wir die stöchiometrischen Beziehungen berücksichtigen, wenn wir den Ratenausdruck geben, um den gesamten Ratenausdruck auszugleichen, der in irgendeiner Weise angegeben ist. Betrachten wir beispielsweise die folgende chemische Reaktion und die Geschwindigkeitsausdrücke, die wir dafür geben können
2x +3y ⟶ 5z
Die folgenden Geschwindigkeitsausdrücke sind für die obige Reaktion möglich:

Was ist Ratengesetz?
Das Geschwindigkeitsgesetz ist der mathematische Ausdruck der Reaktionsrate, die die Beziehung zwischen der Rate der Reaktanten und der Produktrate umfasst. Wir können diese mathematischen Daten experimentell bestimmen und auch die Beziehung überprüfen. Es gibt zwei wichtige Möglichkeiten, wie wir ein Tarifgesetz schreiben können. Differentialrate -Gesetz und integriertes Ratengesetz.
Differentialrategesetz
Das Differentialrategesetz ist der Weg, die Reaktionsgeschwindigkeit unter Verwendung der Änderung der Konzentration eines oder mehrerer Reaktanten auszudrücken. Hier betrachten wir die Änderung der Konzentration der Reaktanten über einen bestimmten Zeitraum. Wir nennen dieses Zeitintervall als ΔT. Wir können die Änderung der Konzentration von Reaktanten „R“ als Δ [r] benennen. Betrachten wir ein Beispiel, um zu verstehen, wie man ein Differentialrate -Gesetz schreibt. Für eine Reaktion, bei der sich der Reaktant „A“ zersetzt, um die Produkte und k zu geben, ist die Geschwindigkeitskonstante, während n die Reihenfolge dieser Reaktion ist, die Gleichung für diese Geschwindigkeit ist wie folgt:
- A ⟶ Produkte
Das Differentialrate -Gesetz lautet wie folgt:
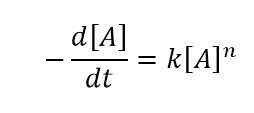
Integriertes Ratengesetz
Das integrierte Ratengesetz ist der Weg, die Reaktionsrate als Funktion der Zeit auszudrücken. Wir können diesen Ausdruck unter Verwendung des Differentialrate -Gesetzes über die Integration des Differentialrate -Gesetzes erhalten. Wir können dieses integrierte Zinsgesetz auch von einem ordentlichen Satz erhalten.
Für die Reaktion A ⟶ Produkte lautet das normale Rate -Gesetz beispielsweise wie folgt:
Rate (r) = k [a]
wobei k die Geschwindigkeitskonstante und [a] die Konzentration von Reaktanten a ist. Wenn wir ein kleines Zeitintervall betrachten, können wir die obige Gleichung wie folgt schreiben:
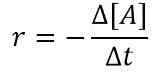
Wir verwenden das Minuszeichen (-) hier, weil a der Reaktant ist und mit zunehmender Zeit die Konzentration von A abnimmt. Dann können wir eine Beziehung wie folgt bekommen, indem wir die oben genannten zwei Gleichungen kombinieren
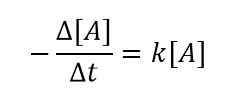
Für eine sehr geringe Änderung der Reaktantenkonzentration in einem sehr geringen Zeitintervall können wir die Gleichung wie unten schreiben
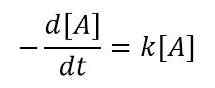
Oder
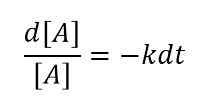
Durch die Integration dieser Gleichung können wir dann die folgende Beziehung erhalten:
ln [a] = -ck +konstant
Wenn die Zeit null oder t = 0 ist, ist Ln [a] die anfängliche Konzentration eines Reaktanten (wir können es als [a] geben0) Da bei t = 0, -Kt = 0 also ln [a]0= konstant. Für eine Reaktion erster Ordnung ist das integrierte Geschwindigkeitsgesetz,
ln [a] = ln [a]0 - kt
Was ist der Unterschied zwischen Ratenausdruck und Ratengesetz?
Ratenausdruck und Rate AW sind zwei Möglichkeiten, Details zur Reaktionsrate zu geben. Der Schlüsselunterschied zwischen Ratenexpression und Ratengesetz besteht darin, dass die Ratenexpression die Erscheinungsrate oder das Verschwinden von Produkten oder Reaktanten ergibt, während das Ratengesetz die Beziehung zwischen Rate und Konzentration oder dem Druck von Reaktanten ergibt.
Nach der Infografik fasst die Differenz zwischen Ratenexpression und Ratengesetz zusammen.
Zusammenfassung -Ratenausdruck gegen Ratengesetz
Ratenausdruck und Ratengesetz sind zwei Möglichkeiten, Details zur Reaktionsrate zu geben. Der Schlüsselunterschied zwischen Ratenexpression und Ratengesetz besteht darin, dass die Ratenexpression die Erscheinungsrate oder das Verschwinden von Produkten oder Reaktanten ergibt, während das Ratengesetz die Beziehung zwischen Rate und Konzentration oder dem Druck von Reaktanten ergibt.
Referenz:
1. „Geschwindigkeitsausdruck und Reaktionsreihenfolge.” LinkedIn Slideshare, 15. September. 2013, hier erhältlich.


