Unterschied zwischen repräsentativen und Übergangselementen
Schlüsselunterschied - Vertreter vs Übergangselemente
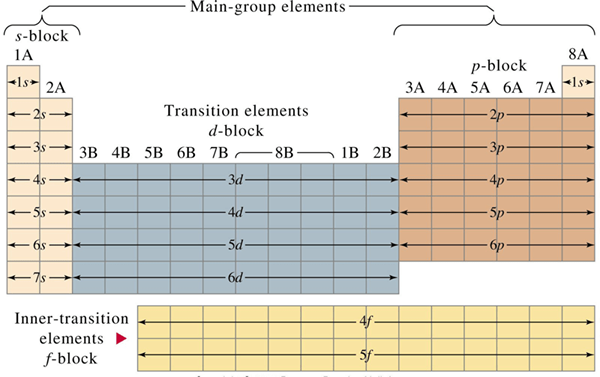
Die periodische Elementtabelle ist eine tabellarische Anordnung aller bekannten chemischen Elemente, die auf ihren Atomzahlen basieren. Es gibt Zeilen oder Zeiträume und Spalten oder Gruppen in der Periodenzüchtertabelle. Es gibt regelmäßige Trends in der Periodenzüchtertabelle. Alle Elemente in der Periodenzüchter können als repräsentative Elemente und Übergangselemente in zwei Gruppen unterteilt werden. Der Schlüsselunterschied Zwischen repräsentativen Elementen und Übergangselementen ist das Repräsentative Elemente sind die chemischen Elemente in Gruppe 1, Gruppe 2 und in den Gruppen von 13 bis 18, während Übergangselemente in Gruppe 3 bis Gruppe 12, einschließlich Lanthaniden und Actinides, chemische Elemente sind.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind repräsentative Elemente
3. Was sind Übergangselemente
4. Seite an Seitenvergleich - Repräsentative gegen Übergangselemente in tabellarischer Form
5. Zusammenfassung
Was sind repräsentative Elemente?
Repräsentative Elemente sind die chemischen Elemente in Gruppe 1, Gruppe 2 und in den Gruppen von 13 bis 18. Repräsentative Elemente werden auch als "Gruppe -A -Elemente" oder "S -Block- und P -Blockelemente" oder "Hauptgruppenelemente" bezeichnet, was bedeutet, dass repräsentative Elemente die folgenden Gruppen chemischer Elemente enthalten
-
S Blockelemente (Alkali -Metalle und alkalische Erdmetalle)
S Blockelemente haben ihre Valenzelektronen in den äußersten S -Orbitalen und befinden sich in zwei Arten als Alkali -Metalle und alkalische Erdmetalle zusammen mit Wasserstoff und Helium. Alkali -Metalle sind Elemente der Gruppe 1 (ohne Wasserstoff), während Alkali -Erdmetalle Gruppe 2 Elemente sind. Diese Metalle werden als solche genannt, weil sie Basis- oder Alkal -Verbindungen bilden. Zu den Alkali -Metallen gehören Lithium, Natrium, Kalium, Rubidium, Cäsium und Frorgium. Zu den alkalischen Erdmetallen gehören Beryllium, Magnesium, Kalzium, Strontium, Barium und Radium.

Abbildung 01: Anordnung des repräsentativen und Übergangselements in der Periodenzüchtertabelle
-
P -Blockelemente (Nichtmetalle, Halogene, edle Gase)
P -Blockelemente haben ihre Valenzelektronen in den äußersten P -Orbitalen. Fast alle P -Blockelemente sind Nichtmetalle, einschließlich einiger Metalloidelemente (ohne Helium, da es sich um ein S -Blockelement handelt). Es gibt einen regelmäßigen Trend in Zeiträumen und in den Gruppen im P -Block. Metalloide umfassen Bor, Silizium, Germanium, Arsen, Antimon und Tellurium. Edelgase sind die Elemente der Gruppe 18 (die abgeschlossen sind eLektronenkonfigurationen). Alle anderen sind Nichtmetalle.
Was sind Übergangselemente?
Übergangselement. Alle Übergangselemente sind Metalle. Sie haben ihre Valenzelektronen in den äußersten D -Orbitalen. Daher sind alle chemischen Elemente von Gruppe 3 bis Gruppe 12 Übergangsmetalle ohne Zink (da Zink keine ungepaarten Elektronen und Zn hat+2 hat auch keine ungepaarten Elektronen. Zn+2 ist das einzige stabile Kation von Zink).
Fast alle Übergangsmetalle haben mehrere stabile Oxidationszustände in verschiedenen Verbindungen. Alle diese Verbindungen sind sehr farbenfroh. Und auch die Bildunterschriften, die dieselben Übergangselemente mit unterschiedlichen Oxidationszuständen enthalten. Der Grund für diese Farbe ist das Vorhandensein von ungepaarten D -Elektronen (sie ermöglicht es den Elektronen, durch Absorbieren von Energie von einem Orbital zum anderen zu springen. Wenn diese Elektronen zum vorherigen Orbital zurückkehren, emittiert es die absorbierte Energie als sichtbares Licht.
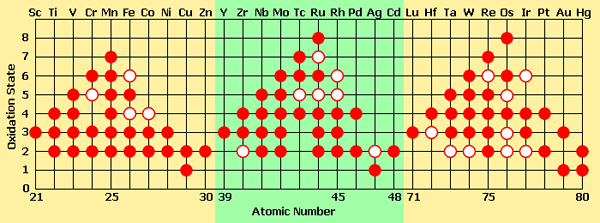
Abbildung 02: Unterschiedliche Oxidationszustände, die durch Übergangsmetalle gebildet werden
Lanthanides und Actinides werden auch als „innere Übergangsmetalle“ bezeichnet, da ihre Valenzelektronen in ihren F -Orbitalen der vorletzten Elektronenschale enthalten sind. Diese Elemente sind im F -Block der Periodenzüchter zu sehen.
Was ist der Unterschied zwischen repräsentativen und Übergangselementen?
Repräsentant gegen Übergangselemente | |
| Repräsentative Elemente sind die chemischen Elemente in Gruppe 1, Gruppe 2 und in den Gruppen von 13 bis 18. | Übergangselement. |
| Mitglieder | |
| Repräsentative Elemente umfassen S -Block- und P -Blockelemente. | Übergangselemente umfassen D -Block- und F -Blockelemente. |
| Gruppen | |
| Repräsentative Elemente befinden sich in der Gruppe1, der Gruppe 2 und in den Gruppen 13 bis 18. | Übergangselemente sind in den Gruppen 3 bis 12 liegen. |
| Farben | |
| Die meisten von repräsentativen Elementen gebildeten Verbindungen sind farblos. | Alle durch Übergangselemente gebildeten Verbindungen sind farbenfroh. |
Zusammenfassung -Vertreter vs Übergangselemente
Repräsentative Elemente sind die Hauptgruppenelemente, die alkalische Metalle, alkalische Erdmetalle, Nichtmetalle und edle Gase umfassen. Übergangsmetalle befinden sich im D -Block und im F -Block der Periodenkabine. Der Unterschied zwischen repräsentativen Elementen und Übergangselementen besteht darin, dass repräsentative Elemente die chemischen Elemente in der Gruppe 1, in Gruppe 2 und in den Gruppen von 13 bis 18 sind, während Übergangselemente in Gruppe 3 bis Gruppe 12, einschließlich Lanthaniden und Actinides, chemische Elemente sind.
Referenz:
1.„Definition des repräsentativen Elements.Sciencing, hier erhältlich
2."Übergangsmetall.”Wikipedia, Wikimedia Foundation, 25. Februar. 2018. Hier verfügbar
3.„Vertreter und Übergangselemente;) - Ein Haiku -Deck von Jade Bailey.Haiku -Deck: Präsentationssoftware und Online -Präsentationstools. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.'Ptable struction'by sch0013r, (cc by-sa 3.0) über Commons Wikimedia
2.'Übergang Metalloxidationszustände 2'by kein maschinenlesbarer Autor zur Verfügung gestellt. Felix Wan nahm an (basierend auf Urheberrechtsansprüchen). (CC BY-SA 3.0) über Commons Wikimedia


