Unterschied zwischen Löslichkeit und Löslichkeitsprodukt
Der Schlüsselunterschied Zwischen Löslichkeit und Löslichkeitsprodukt besteht die Löslichkeit beschreibt die Auflösung einer Substanz in einem Lösungsmittel, während das Löslichkeitsprodukt das mathematische Produkt der gelösten Ionenkonzentrationen beschreibt, die zur Kraft ihrer stöchiometrischen Koeffizienten angehoben werden.
Nach der oben genannten Differenz sind Löslichkeits- und Löslichkeitsprodukte zwei verwandte Begriffe. Daher können wir das Löslichkeitsprodukt einer Substanz verwenden, um die Löslichkeit dieser Substanz zu verstehen. Je kleiner das Löslichkeitsprodukt ist, desto niedriger die Löslichkeit.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Löslichkeit?
3. Was ist Löslichkeitsprodukt
4. Nebeneinander Vergleich - Löslichkeit gegen Löslichkeitsprodukt in tabellarischer Form
5. Zusammenfassung
Was ist Löslichkeit??
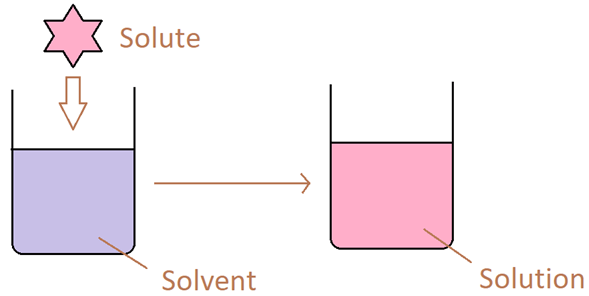
Löslichkeit ist Eigentum einer Substanz, die sich in einem Lösungsmittel auflöst. Hier nennen wir die Substanz (die sich im Lösungsmittel auflöst) als „gelöste“. Es kann eine feste, flüssige oder gasförmige Substanz sein. Lösungsmittel hingegen kann auch im festen, flüssigen oder gasförmigen Zustand sein. Die Löslichkeit einer Substanz hängt von den chemischen und physikalischen Eigenschaften von gelösten Stoff und Lösungsmittel ab. Darüber hinaus hängt es von den externen Faktoren des gelösten Systems ab. Temperatur, Druck usw.

Abbildung 01: Bildung einer Lösung aus der Auflösung eines gelösten Stoffes in einem Lösungsmittel
Eine Substanz kann sich in einem geeigneten Lösungsmittel auflösen, bis das Lösungsmittel von dieser Substanz gesättigt wird. Es ist die maximale Menge an gelösten Molekülen, die das Lösungsmittel bei der bereitgestellten Temperatur und Druck halten kann. Im Gegensatz dazu kann Unlöslichkeit nicht in der Substanz auflösen. Löslichkeit beschreibt jedoch nicht die Fähigkeit, einen Substanz aufzulösen, da wir auch durch chemische Reaktionen Substanzen auflösen können. Die Faktoren, die die Löslichkeit eines gelösten Stoffes beeinflussen, sind wie folgt:
- Temperatur
- Druck
- Vorhandensein anderer Chemikalien
- Die Polarität des gelösten Stoffes und des Lösungsmittels
- Intermolekulare Kräfte zwischen gelösten und lösungsmittel
- pH
- Größe von gelösten Molekülen
Was ist Löslichkeitsprodukt?
Löslichkeitsprodukt ist die mathematische Ableitung, die das Gleichgewicht zwischen gelösten und ungelösten Arten einer Substanz in einem Lösungsmittel zeigt. Daher repräsentiert es das Niveau, auf dem sich ein gelöster Stoff in einer Lösung auflöst. Genauer.
Löslichkeitsprodukt ist ein konstanter Wert für eine bestimmte Substanz bei einer bestimmten Temperatur und einem bestimmten Druck. Deshalb nennen wir es die „Löslichkeitsproduktkonstante“. Wir können es als KSP bezeichnen. Dieser Begriff steht in direktem Zusammenhang mit der Löslichkeit einer Substanz; höher der KSP, höher die Löslichkeit. Darüber hinaus ist es eine heterogene Gleichgewichtskonstante. Wir verwenden diesen Begriff mit Lösungen, die mit einem bestimmten gelösten Stoff gesättigt sind. Diese Konstante hängt immer von der Temperatur ab. Betrachten wir ein Beispiel, um eine Vorstellung davon zu bekommen.
aa(S) ↔ BB(aq) + CC(aq)
Das obige System hat sich auf die B- und C -Produkte gelöst und auch aufmacht A. A. Dann lautet die Löslichkeitsproduktkonstante wie folgt:
Ksp = [b]B.[C]C
Was ist der Unterschied zwischen Löslichkeit und Löslichkeitsprodukt?
Löslichkeit ist Eigentum einer Substanz, die sich in einem Lösungsmittel auflöst. Einfach beschreibt es die Auflösung einer Substanz in einem Lösungsmittel. Löslichkeitsprodukt ist die mathematische Ableitung, die das Gleichgewicht zwischen gelösten und ungelösten Arten einer Substanz in einem Lösungsmittel zeigt. Dieser Begriff beschreibt das mathematische Produkt der gelösten Ionenkonzentrationen, die zur Macht ihrer stöchiometrischen Koeffizienten angehoben werden. Dies ist der Hauptunterschied zwischen Löslichkeit und Löslichkeitsprodukt. Darüber hinaus beziehen sich diese beiden Begriffe aufeinander, da das Löslichkeitsprodukt einer Substanz die Löslichkeit dieser Substanz beschreibt.

Zusammenfassung -Löslichkeit gegen Löslichkeitsprodukt
Löslichkeit und Löslichkeitsprodukt sind zwei verwandte Begriffe. Der Unterschied zwischen Löslichkeit und Löslichkeitsprodukt besteht darin.
Referenz:
1. "Löslichkeit.Wikipedia, Wikimedia Foundation, 27. Juli 2018. Hier verfügbar
2. Libretexten. „Löslichkeitsproduktkonstante, KSP.”Chemistry Libretexten, Libretexte, 21. Juli 2016. Hier verfügbar


