Unterschied zwischen Schwefelhexafluorid und Disulfur Tetrafluorid
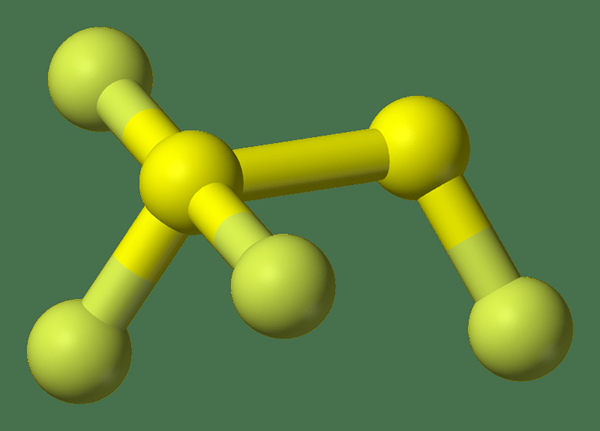
Der Schlüsselunterschied Zwischen Schwefelhexafluorid und Disulfur Tetrafluorid ist Dieser Schwefelhexafluorid hat chemische Bindungen mit gleichen Bindungslängen, aber Disulfur -Tetrafluorid hat chemische Bindungen mit unterschiedlichen Bindungslängen.
Schwefelhexafluorid und Disulfur -Tetrafluorid sind anorganische Verbindungen. Beide enthalten Schwefel- und Fluoratome in unterschiedlichen Konnektivität und räumlichen Anordnungen. Nicht nur ihre chemische Struktur, sondern auch der physikalische Zustand und andere Eigenschaften dieser beiden Verbindungen unterscheiden sich auch voneinander. Zum Beispiel ist Schwefelhexafluorid eine gasförmige Verbindung bei Raumtemperatur, aber Disulfur Tetrafluorid ist eine Flüssigkeit.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Schwefelhexafluorid
3. Was ist Disulfur Tetrafluorid
4. Seite an Seitenvergleich - Schwefelhexafluorid gegen Disulfur Tetrafluorid in tabellarischer Form
5. Zusammenfassung
Was ist Schwefelhexafluorid?
Schwefelhexafluorid ist eine anorganische Verbindung mit der chemischen Formel SF6. Es ist eine farblose und geruchlose gasförmige Verbindung, die nicht flammbar und ungiftig ist. Es wird als Gewächshausgas eingestuft. Es ist auch ein wichtiger elektrischer Isolator. Es ist ein dichtes Gas als Luft.
Die Geometrie dieser Verbindung ist oktaedrisch. Die Bindungslängen aller S-F-Bindungen in diesem Molekül sind gleich. Schwefelhexafluorid hat ein zentrales Schwefelatom, das an sechs Fluoratomen gebunden ist. Darüber hinaus wird dieses Molekül als hypervalentes Molekül betrachtet. Das bedeutet; Dieses Molekül verfügt über ein Hauptgruppenelement mit mehr als acht Valenzelektronen. In diesem Molekül hat das Schwefelatom zwölf Elektronen.
Aufgrund der Konnektivität von Atomen und ihrer räumlichen Anordnung ist das Schwefelhexafluorid -Molekül unpolar und in Wasser unlöslich. Aber es ist löslich in nichtpolaren organischen Lösungsmitteln. Wir können diese Verbindung mit dem reinen elementaren Schwefel und Fluor produzieren. Hier müssen wir s entlarven8 solide zum f2 Gas.
Es gibt viele Anwendungen von Schwefelhexafluorid:
- Als elektrischer Isolator Elektrische Industrie verwendet
- In der Medizin zur Bereitstellung einer Tamponade bei Netzhautablösungen
- Als Kontrastmittel in der Ultraschallbildgebung,
- Als Tracer -Gas im kalibrierenden Straßenluftdispersionsmodell usw. usw.
Was ist Disulfur Tetrafluorid?
Disulfur Tetrafluorid ist eine anorganische Verbindung mit der chemischen Formel s2F4. Genauer gesagt können wir die strukturelle Formel für diese Verbindung als FSSF schreiben3 Da es drei Fluoratome hat, die an ein Schwefelatom gebunden sind und das andere Schwefelatom das verbleibende Fluoratom enthält. Die Bindungslängen dieses Moleküls sind unterschiedlich, was eine ungewöhnliche Eigenschaft von anorganischen Molekülen ist.
Die Molmasse dieser Verbindung beträgt 140 g/mol. Es existiert im flüssigen Zustand bei Raumtemperatur. Darüber hinaus wird das Disulfur Tetrafluorid leicht mit Wasser hydrolyse unterzogen. Es reagiert auch spontan mit Sauerstoff, um Thionylfluorid zu bilden. Wir können Disulfur -Tetrafluorid im Labor unter Verwendung von Schwefeldelchlorid vorbereiten, das bei niedrigem Druck und niedriger Temperatur über Kaliumfluorid geleitet wird. Diese Reaktion ergibt jedoch mehrere Nebenprodukte, einschließlich verschiedener Chloride und Schwefelfluoride. Wir können die gewünschte Verbindung über die Destillation mit niedriger Temperatur trennen.
Was ist der Unterschied zwischen Schwefelhexafluorid und Disulfur Tetrafluorid?
Schwefelhexafluorid und Disulfur -Tetrafluorid sind anorganische Verbindungen, die Schwefel- und Fluoratome enthalten. Der Schlüsselunterschied zwischen Schwefelhexafluorid und Disulfur -Tetrafruorid besteht darin, dass Schwefelhexafluorid chemische Bindungen mit gleicher Bindungslänge aufweist. Darüber hinaus ist Schwefelhexafluorid eine gasförmige Verbindung bei Raumtemperatur, aber das Disulfur -Tetrafluorid ist eine Flüssigkeit. Dies ist also ein weiterer signifikanter Unterschied zwischen Schwefelhexafluorid und Disulfur Tetrafluorid.
Darüber hinaus beträgt die Molmasse des Schwefelhexafluorids 146 g/mol, während die Molmasse von Disulfur Tetrafluorid 140 g/mol beträgt. Außerdem können wir Schwefelhexafluorid durch Verwendung des reinen Elementarschwefels und Fluors produzieren, während die Vorbereitung von Disulfurtetrafluorid bei niedrigem Druck und niedriger Temperatur und Trennung mit niedriger Temperaturdestillation ein Schwefelchlorid über Kaliumfluorid erfordert.

Zusammenfassung -Schwefelhexafluorid gegen Disulfur Tetrafluorid
Schwefelhexafluorid und Disulfur -Tetrafluorid sind anorganische Verbindungen, die Schwefel- und Fluoratome enthalten. Der wichtigste Unterschied zwischen Schwefelhexafluorid und Disulfur -Tetrafluorid besteht darin.
Referenz:
1. „Difluorodisulfanedifluorid.” Wikipedia, Wikimedia Foundation, 26. Oktober. 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Schwefel-Hexafluorid-3D-VDW" (Public Domain) über Commons Wikimedia
2. "Disulfur-Tetrafluorid-3D-Balls" von Benjah-BMM27-eigene Arbeit (Public Domain) über Commons Wikimedia


