Unterschied zwischen Toluol und Xylol
Der Schlüsselunterschied Zwischen Toluol und Xylol ist das Toluol enthält eine an einem Benzolring gebundene Methylgruppe, während Xylol zwei Methylgruppen enthält, die an einem Benzolring gebunden sind.
Sowohl Toluol als auch Xylol sind wichtige organische Verbindungen mit eng ähnlichen chemischen Strukturen. Beide sind aromatische Verbindungen, die Benzolringe und angeschlossene Methylgruppen (en) enthalten.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Toluol
3. Was ist Xylol
4. Seite an Seitenvergleich - Toluol gegen Xylol in tabellarischer Form
5. Zusammenfassung
Was ist Toluol?
Toluol ist eine organische Verbindung mit der chemischen Formel C7H8. Der IUPAC -Name für Toluol ist Methylbenzol. Es enthält einen Benzolring, der an einer Methylgruppe angebracht ist. Die Molmasse dieser Verbindung beträgt ungefähr 92.14 g/mol. Bei Raumtemperatur und Druck erscheint es als farblose Flüssigkeit mit einem scharfen Benzol-ähnlichen Geruch.
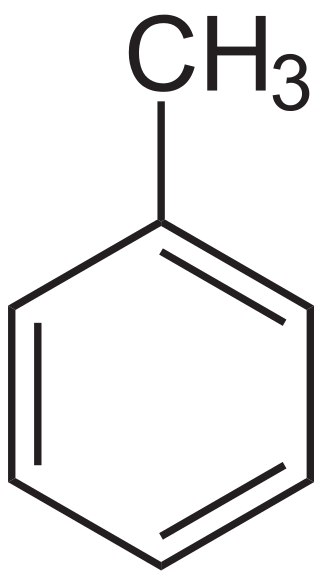
Abbildung 01: Die chemische Struktur von Toluol
Der Siedepunkt von Toluol beträgt etwa 111 ° C. Es ist eine hochflammbare flüssige Verbindung. Es wird als Benzolderivat betrachtet. Es kann elektrophile aromatische Substitutionsreaktionen erfahren. Toluol ist aufgrund des Vorhandenseins einer Methylgruppe hochreaktiv. Methylgruppen sind gute Elektronenfreisetzungsgruppen. Daher trägt die im Toluolmolekül vorhandene Methylgruppe dazu bei. Daher kann es leicht Elektronen mit Elektrophilen teilen.
Toluol ist sehr nützlich bei organischen Reaktionen. Es kann als Ausgangsmaterial zur Herstellung von Benzol verwendet werden. Es gibt ein Benzolmolekül zusammen mit einem Methan (CH4) Molekül als Endprodukte. Toluol ist ein gutes Lösungsmittel, das üblicherweise bei der Herstellung von Farben verwendet wird. Es wird manchmal aufgrund seiner hohen Entflammbarkeit als Kraftstoff verwendet. Toluol wird jedoch als toxische Verbindung betrachtet.
Was ist Xylol?
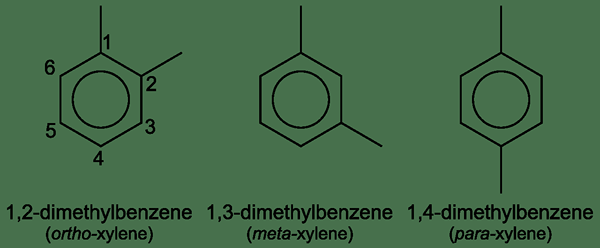
Xylol ist eine organische Verbindung mit der chemischen Formel (CH3)2C6H4. Es fällt unter die Kategorie von Dimethylbenzol, da es ein Benzol mit zwei angeschlossenen Methylgruppen hat. Darüber hinaus hat diese Verbindung drei Isomere, deren Positionen von Methylgruppen am Benzolring voneinander unterscheiden. Alle diese drei Isomere treten als farblose, brennbare Flüssigkeiten auf; Genauer gesagt wird eine Mischung dieser Isomere als „Xyllene“ bezeichnet.

Abbildung 02: Xylolstruktur
Die Produktion von Xylol kann durch katalytische Reformierung während der Raffination von Erdöl oder durch Kohlekarbonisierung während der Herstellung von Koksbrennstoffen durchgeführt werden. Die von uns verwendete industrielles Xylolproduktionsmethode ist jedoch die Methylierung von Toluol und Benzol.
Xylol ist als unpolares Lösungsmittel wichtig. Es ist jedoch teuer und vergleichsweise giftig. Die unpolare Natur ist auf den geringen Unterschied der Elektronegativität zwischen C und H zurückzuführen. Daher neigt Xylol dazu, lipophile Substanzen gut aufzulösen.
Gemäß der Stelle, an der zwei Methylgruppen am Benzolring gebunden sind. Diese drei Begriffe stehen für Ortho-, Para- und Meta -Positionen der beiden Methylgruppen.
Was ist der Unterschied zwischen Toluol und Xylol?
Toluol und Xylol sind aromatische organische Verbindungen. Der Schlüsselunterschied zwischen Toluol und Xylol besteht darin, dass Toluol eine an einem Benzolring gebundene Methylgruppe enthält, während Xylol zwei Methylgruppen enthält, die an einem Benzolring gebunden sind.
Die folgende Tabelle zeigt mehr Komprions im Zusammenhang mit dem Unterschied zwischen Toluol und Xylol.
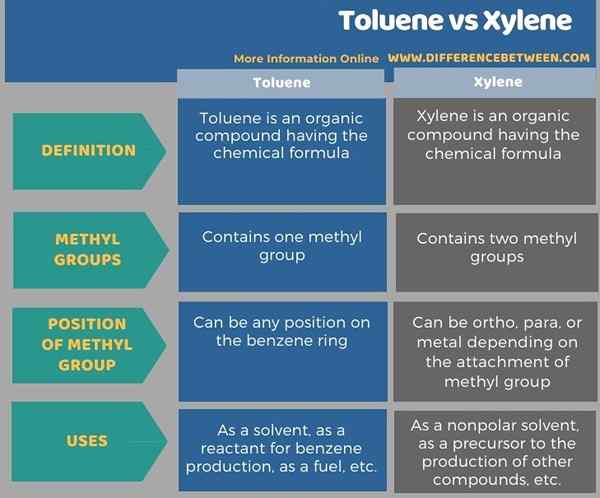
Zusammenfassung -Toluol gegen Xylol
Toluol und Xylol sind aromatische organische Verbindungen. Der Schlüsselunterschied zwischen Toluol und Xylol besteht darin, dass Toluol eine an einem Benzolring gebundene Methylgruppe enthält, während Xylol zwei Methylgruppen enthält, die an einem Benzolring gebunden sind.
Referenz:
1. "Toluol.” Wikipedia, Wikimedia Foundation, 4. Mai 2020, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Toluol" von Neurotiker - eigene Arbeit (Public Domain) über Commons Wikimedia
2. "IUPAC-Cyclic" von Fvasconcellos 20:19, 8. Januar 2008 (UTC). Originalbild von DRBOB (Talk · Beiträge). - Vektorversion von Bild: IUPAC-Cyclic.PNG von DRBOB (talk · Beiträge) (CC BY-SA 3.0) über Commons Wikimedia


